РЕКОМЕНДАЦИИ ШКОЛЬНИКУ ПО РАБОТЕ С КНИГОЙ
Сначала медленно прочитайте параграф, чтобы разобраться и понять каждое предложение.
Возможно, некоторые предложения придётся перечитывать, чтобы понять до конца всё написанное в них. Затем перечитайте ещё раз, чтобы «отдельные пазлы сложились в картину».
Далее нужно запомнить все определения, которые встречались в тексте, названия веществ и т.д. Например, в теме «Строение атома» нужно запомнить абсолютно всё: что протон – положительная частица с массой 1, p-облако имеет гантелеобразную форму, а s-облако – шарообразную, что d-подуровень состоит из 5 орбиталей и т.д.
Выучить надо так, как учили стихи в начальной школе: надолго и на 5+!
Возможно, кому-то ещё раз или два придётся перечитать параграф. Это индивидуально. И только потом приступите к выполнению заданий. Если после сверки с ответами у вас были ошибки, разберитесь – почему. Для этого опять придётся обратиться к параграфу, чтобы найти ответ на данный вопрос. И это говорит о том, что вы ещё не знаете тему на 5+ и вам нельзя переходить к следующей теме. Нельзя допускать пробелы в знаниях. Их труднее ликвидировать. Лучше сразу изучить тему на 5.
Если вы, имея пробелы по теме, всё же перейдёте к изучению следующей, то её вы можете плохо понять, а ещё следующую – совсем не поймёте, так как темы связаны одна с другой, также как и в математике: если вы плохо знаете таблицу умножения, то вы не выполните ни одного задания где нужно применить это знание. А таких заданий много.
И если накопится много пробелов в разных темах, то вы вообще можете не ответить ни на один тестовый вопрос, так как в реальных вариантах один тест составлен таким образом, что для правильного ответа необходимо знание нескольких тем.
Если ошибки допущены только по невнимательности, то можно переходить к изучению следующей темы, но со своей невнимательностью также нужно работать.
Лучше приступить к подготовке к ЕГЭ за 2 года до его начала. Если же у вас осталось только 8-9 месяцев, то это значит, что вам предстоит огромная работа, будьте к этому готовы. Вы должны в месяц пройти 3 главы книги или 23 параграфа. Если вы будете заниматься 2 раза в неделю, то необходимо за одно занятие осваивать примерно 3 параграфа, уже на 5+.
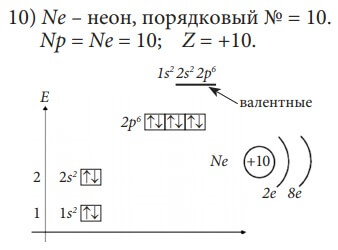
ГЛАВА 1. СТРОЕНИЕ АТОМА
§1.1. Состав атома.
Согласно атомно-молекулярного учения М. В. Ломоносова:
1) Все вещества состоят из молекул;
2) Молекулы состоят из атомов;
3) Молекулы и атомы находятся в непрерывном движении;
4) Молекулы простых веществ состоят из одинаковых атомов, а сложных – из разных атомов.
Молекула – это наименьшая частица вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются её составом и строением.
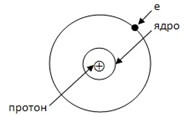
Атом – электронейтральная частица, состоящая из положительно заряженного ядра Z и отрицательно заряженных электронов, движущихся вокруг ядра. Ядро атома состоит из протонов – положительно заряженных частиц с массой 1 а. е. м. (атомная единица массы), и нейтронов – нейтральных частиц с массой 1 а. е. м. Масса электрона примерно в 2000 раз меньше 1 а. е. м., ею пренебрегают, принимая равной нулю.
Элементарные частицы, входящие в состав атома:
Верхний индекс в обозначении частицы означает массу частицы, а нижний – указывает на её заряд.
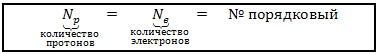
Так как атом электронейтрален, то количество в нём положительных частиц (протонов) равно количеству отрицательных частиц (электронов) и равно порядковому номеру элемента в таблице Д. И. Менделеева.
Заряд ядра атома Z равен числу протонов:

Так как массу имеют только протоны и нейтроны, то они и будут составлять относительную массу атома Ar (Элемента). Следовательно, количество нейтронов в атоме можно найти по формуле:
Пример. Рассчитаем количество протонов, нейтронов и электронов для атома фосфора P. Его порядковый номер 15.
Np=Ne=№ порядковый=15 Nn=Ar(P) - № порядковый = 31 - 15 = 16
В природе имеются атомы фосфора только массой 31 а. е. м. Что касается большинства других элементов, то они существуют в виде атомов различной массы. Разновидности атомов одного элемента, имеющие одинаковый заряд ядра (а значит и одинаковое число протонов) и различную массу (а значит и разное число нейтронов) называются изотопами. Например, химический элемент водород имеет три изотопа:
Они различаются только количеством нейтронов: у протия их нет, у дейтерия – 1 нейтрон, у трития Nn=2.
Химический элемент хлор имеет 2 изотопа:
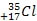
и
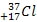
. Массовая доля атомов
35Cl составляет ~ 75%, а массовая доля
37Cl ~ 25%. Средняя относительная атомная масса получается дробной:
Ar(Cl) = 35 ⋅ 0,75 + 37 ⋅ 0,25 = 35,5.
То есть дробная атомная масса элементов объясняется наличием у данного элемента изотопов.
Задания для закрепления
1) Выучите названия некоторых элементов периодической системы Д. И. Менделеева: H, He, Li, Be, B, C, N, O, F, Ne, Na, Mg, Al, Si, P, S, Cl, Ar, K, Ca,
Ag, Cd, Cs, Ba, Au, Hg, Sn, Pb, I, Cr, Mn, Fe, Cu, Zn, As, Br, Rb, Sr.
2) Определите количество протонов, нейтронов и электронов для атомов: 39K, 79Br, 39Ar, 40Ca, 35Cl, 40Ar, 10B, 20Ne, 42Ca, 81Br, 26Mg, 29Si, 34S.
3) Одинаковое число протонов и нейтронов содержится в атоме:
1) 42Ca 2) 23Na 3) 27Al 4) 14N
Укажите номер правильного ответа (одна цифра).
4) Число нейтронов в атоме 14N равно числу нейтронов в атоме:
1) 11B 2) 16O 3) 13C 4) 10B
Укажите номер правильного ответа (одна цифра).
5) Число протонов в атоме 42Ca равно:
1) 20 2) 42 3) 22 4) 4
Укажите номер правильного ответа (одна цифра).
6) Число нейтронов в ядре атома 52Cr равно:
1) 6 2) 24 3) 4 4) 28
Укажите номер правильного ответа (одна цифра).
7) 12 нейтронов содержит атом:
1) 27Al 2) 31P 3) 19F 4) 24Mg
Укажите номер правильного ответа (одна цифра).
8) Заряд ядра атома марганца:
1) 55 2) -25 3) +25 4) -55
Укажите номер правильного ответа (одна цифра).
9) Определите, у наиболее распространённых изотопов каких элементов в составе атомного ядра число протонов равно числу нейтронов:
1) Si 2) Cr 3) C 4) Pb 5) Cu
Укажите два номера правильных ответов (две цифры).
10) Из предложенного перечня выберите два элемента, являющихся изотопами. Укажите их в порядке возрастания относительной атомной массы:
1)
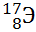
2)
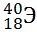
3)
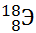
4)
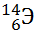
5)
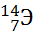
Укажите два номера правильных ответов (две цифры).
11) Из предложенного перечня выберите два атома, у которых число протонов равно числу нейтронов. Расположите их в порядке возрастания заряда ядра.
1) 18O 2) 31P 3) 17O 4) 24Mg 5) 28Si
Укажите два номера правильных ответов (две цифры).
12) Определите, у каких из указанных атомов число нейтронов равно заряду их ядра.
1) 34S 2) 44Ca 3) 14N 4) 13C 5) 40Ca
Укажите два номера правильных ответов (две цифры).
13) Из предложенного перечня выберите два атома, содержащих одинаковое число электронов.
1)
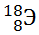
2)
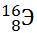
3)
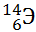
4)
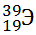
5)
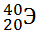
Укажите два номера правильных ответов (две цифры).
§1.2. Электронное облако. Электронная орбиталь.
Согласно квантовой механике, электроны обладают двойственной природой, корпускулярно-волновым дуализмом, то есть они одновременно проявляют свойства частицы (имеют массу и заряд) и волны (характеризуются частотой колебаний и длиной волны, способны к дифракции и интерференции).
Движение электрона в атоме грубо можно сравнить с движением Земли вокруг Солнца. Между ними существует сила всемирного притяжения, но Земля не падает на Солнце благодаря центробежной силе, уравновешивающей силу притяжения. Отрицательный электрон притягивается к положительному ядру, но они не сливаются друг с другом вследствие движения электрона вокруг ядра. Нужно помнить, что в мире элементарных частиц (протонов, нейтронов и электронов) действуют законы квантовой механики, а в макромире – совсем другие законы.
Говоря о движении электрона, можно говорить лишь о вероятности нахождения его в той или иной точке пространства вокруг ядра, так как скорость электрона огромна. Но вероятность его нахождения в разных частях этого пространства неодинакова. Электрон в атоме можно представить в виде электронного облака с различной плотностью отрицательного заряда.
Область пространства вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью. Орбитали различаются по форме и по размерам (энергии).
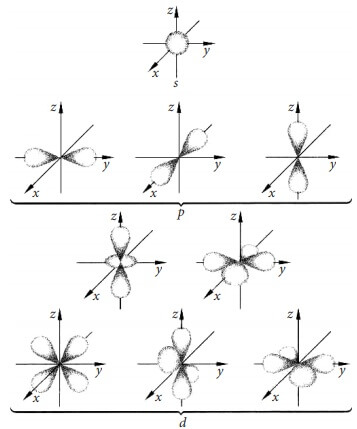
Рис. 1. Форма и расположение в пространстве s, p и d-орбиталей.
Различают
s, p, d и f электроны, в зависимости от того какие облака они образуют при своём движении. Орбиталь схематично изображают горизонтальной чертой «-» или квадратиком «

».
Кроме движения вокруг ядра электрон обладает и собственным моментом количества движения (спином), что можно упрощенно рассматривать как результат вращения электрона вокруг своей оси подобно движению земли вокруг собственной оси.
Схематично электрон обозначают стрелкой «

» (движение электрона по часовой стрелке вокруг своей оси) или «

» (против часовой стрелки).
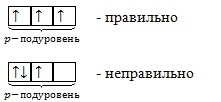
На одной орбитали может находиться только два электрона и только с разными спинами:
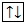
- правильно,

- неправильно.
Строение атома водорода выглядит так:
Но атомы более сложные, допустим, в котором 53 протона и 53 электрона, трудно изобразить простым рисунком, поэтому
существует три способа изображения строения атома. Один из них – расположение электронов по орбиталям. Для атома водорода, имеющего один электрон, можно записать:
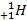

.
§1.3. Строение электронных оболочек атомов.
Энергетический уровень.
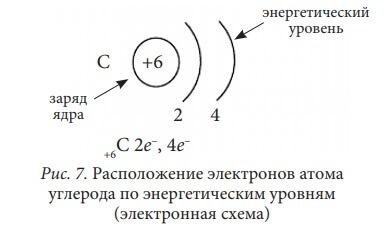
Электрон, движущийся вокруг ядра на определённом расстоянии от него, обладает определённой энергией. Про него говорят: он находится на энергетическом уровне. Ближайший к ядру энергетический уровень – первый. Электроны, находящиеся на нём, обладают наименьшим запасом энергии. Второй энергетический уровень (другое его название – электронный слой) находится дальше от ядра, и, соответственно, электроны этого уровня обладают большим запасом энергии и слабее притянуты к ядру.
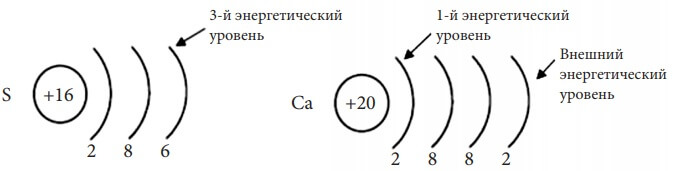
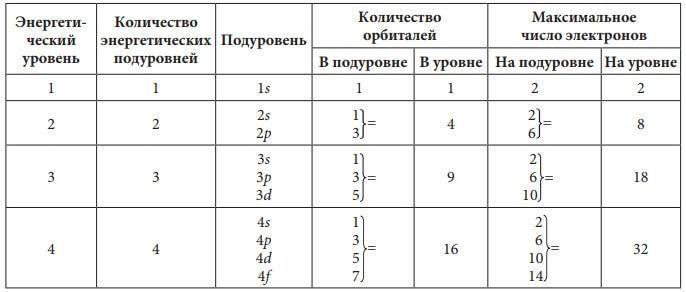
Таким образом, электронная оболочка атома слоистая, состоит из электронных слоёв (энергетических уровней). Количество энергетических уровней в атоме равно номеру периода. Например, атом серы (S) находится в III-ем периоде периодической системы Д. И. Менделеева, у него – три электронных слоя. Атом кальция находится в IV периоде, у него – 4 энергетических уровня. Схематично энергетический уровень изображают дугой с указанием внизу этой дуги количества находящихся на нём электронов:
Рис. 2. Расположение электронов по энергетическим уровням (электронная схема).
Это второй способ изображения строения атома – расположение электронов по энергетический уровням:
+16S 2e-, 8e-, 6e- +20Ca 2e-, 8e-, 8e-, 2e-
Каждый энергетический уровень имеет свой набор орбиталей. На первом энергетическом уровне – одна s-орбиталь, на втором энергетическом уровне – одна s-орбиталь большего размера и три p-орбитали. Чем дальше от ядра, тем большее количество орбиталей может разместиться на энергетическом уровне.
Орбитали одного типа в пределах одного энергетического уровня образуют подуровень. S-подуровень состоит из одной s-орбитали; p-подуровень – из трех p-орбиталей, расположенных взаимно перпендикулярно друг к другу; d-подуровень – из пяти орбиталей; f-подуровень – из 7 орбиталей.

Рис. 3. Схематичное изображение подуровней.
В таблице 1 дано строение электронной оболочки атома:
Табл. 1. Строение электронной оболочки атома.
Задания для закрепления
14) Схематичное изображение электронной орбитали:
1)
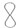
2)

3)

4)
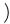
Укажите номер правильного ответа (одна цифра).
15) Число электронных слоев в атоме мышьяка:
1) 2 2) 3 3) 4 4) 5
Укажите номер правильного ответа (одна цифра).
16) P-орбиталь имеет форму:
1) Шарообразную;
2) Гантелеобразную;
3) Грушеобразную;
4) Четырехлепестковую;
Укажите номер правильного ответа (одна цифра).
17) Схематичное изображение электрона:
1) - 2)

3)

4)
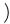
Укажите номер правильного ответа (одна цифра).
18) Число орбиталей на s-подуровне равно:
1) 1 2) 3 3) 5 4) 7
Укажите номер правильного ответа (одна цифра).
19) Максимальное число электронов, способное разместиться на одной орбитали:
1) 1 2) 2 3) 3 4) 4
Укажите номер правильного ответа (одна цифра).
20) Количество энергетических уровней в атоме брома:
1) 4 2) 5 3) 7 4) 9
Укажите номер правильного ответа (одна цифра).
21) Число подуровней на третьем энергетическом уровне:
1) 1 2) 2 3) 3 4) 4
Укажите номер правильного ответа (одна цифра).
22) Общее число орбиталей на втором энергетическом уровне:
1) 2 2) 3 3) 4 4) 5
Укажите номер правильного ответа (одна цифра).
23) Число орбиталей на p-подуровне:
1) 1 2) 3 3) 5 4) 7
Укажите номер правильного ответа (одна цифра).
24) Схематичное изображение
d-подуровня:
1)

2)

3)

4)

Укажите номер правильного ответа (одна цифра).
25) Максимальное число электронов, способное разместиться на втором энергетическом уровне:
1) 2 2) 8 3) 6 4) 9
Укажите номер правильного ответа (одна цифра).
26) Из предложенного перечня рисунков выберите те, которые соответствуют схематичному изображению электрона X и орбитали Y:
1)
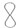
2)

3)

4)
5)

Ответ:
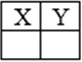
Укажите два номера правильных ответов (две цифры).
27) Из предложенного перечня выберите два элемента, атомы которых имеют 4 электронных слоя:
1)
Zn 2)
P 3)
Si 4)
C 5)
Br
Ответ:

Укажите два номера правильных ответов (две цифры).
28) Максимально возможное число электронов на орбитали X и на s-подуровне Y:
Ответ:

Укажите два номера правильных ответов (две цифры).
29) Из предложенного перечня элементов выберите два, в атомах которых столько же энергетических уровней, сколько орбиталей на p-подуровне:
1) Sr 2) Al 3) Sn 4) S 5) B
Ответ:

Укажите два номера правильных ответов (две цифры).
§1.4. Заполнение электронами орбиталей.
Электронные конфигурации атомов.
Существуют правила заполнения электронных орбиталей:
1) Принцип наименьшей энергии. В соответствии с этим принципом сначала заполняются орбитали с меньшей энергией, а затем с большей. На рис. 4 изображена энергетическая диаграмма орбиталей. Как следует из диаграммы, после заполнения 3p-орбиталей будет заполняться 4s-орбиталь, а не 3d, так как по энергии 4s-орбиталь ниже, чем 3d.
Таким образом, орбитали (энергетические подуровни) можно расположить в следующий ряд в порядке возрастания их энергии:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f ~ 5d < 6p < 7s < 5f ~ 6d < 7p
Такой ряд запомнить трудно, в дальнейшем научимся извлекать эти знания из таблицы Д. И. Менделеева.
2) Принцип Паули: на одной орбитали могут располагаться только два электрона и только с разными спинами:  - правильно,
- правильно,  - неправильно.
- неправильно.
3) Правило Хунда: если орбитали имеют одинаковую энергию, то электронами заполняется максимальное их число.
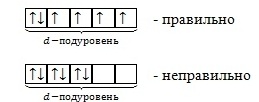
Сначала орбитали одного подуровня заполняются по порядку по одному электрону, затем также по порядку по второму электрону.
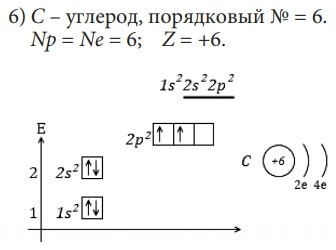
Зная эти правила, можно расположить по орбиталям электроны любого атома. Возьмём атом углерода. Его порядковый номер 6. Рассчитаем количество протонов и электронов.
Np= Ne = № порядковый = 6.
Заряд ядра Z = Np = +6.
Атом углерода находится во втором периоде, следовательно, у него два энергетических уровня. Построим энергетическую диаграмму, как на рисунке 5, где укажем орбитали только первых двух энергетических уровней:
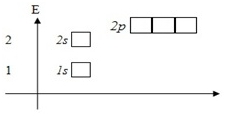
Шесть электронов атома C разместим на орбиталях в порядке возрастания энергии. Сначала заполним 1s-орбиталь (s-орбиталь первого энергетического уровня) двумя электронами. Затем 2s-орбиталь. Осталось ещё два электрона. В соответствии с правилом 3 заполним 2p-орбитали – по одному электрону на двух орбиталях:
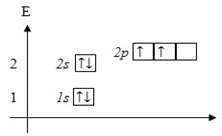
Рис. 5. Расположение электронов атома углерода по орбиталям (электронно-графическая формула).
Запишем орбитали в порядке возрастания энергии и укажем количество электронов на них при помощи верхних индексов:
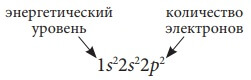 - это электронная формула атома углерода, или электронная конфигурация, третий способ изображения строения атома.
- это электронная формула атома углерода, или электронная конфигурация, третий способ изображения строения атома. Расшифровывается так: на первом энергетическом уровне на
s-подуровне имеется два электрона, на втором энергетическом уровне на
s-подуровне располагаются два электрона, на втором энергетическом уровне на
p-подуровне находятся два электрона. Объединив электроны каждого энергетического уровня (складывая верхние индексы), получим расположение электронов по энергетическим уровням:
Следовательно, электронное строение атомов можно представить тремя способами:
1) Расположением электронов по орбиталям;
2) Электронной формулой (конфигурацией);
3) Расположением электронов по энергетическим уровням.
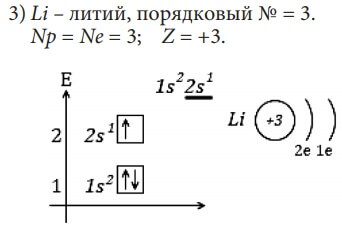
Изобразим электронное строение первых десяти элементов, учитывая то, что у каждого следующего элемента на один протон и один электрон больше. Валентные электроны в электронных формулах подчеркнуты.
Элементы H и He относятся к s-элементам, так как у них идёт заполнение электронами 1s-орбитали
Li и Be также s-элементы, так как у них заполняется 2s-орбиталь.
B и C относятся к p-элементам, так как последний электрон у них пришёл на p-подуровень. Всего p-элементов 6 – по максимальному количеству электронов, которые могут разместиться на p-подуровне (на трёх орбиталях).
Все десять рассмотренных элементов располагаются в главных подгруппах (А-подгруппах) в таблице Д. И. Менделеева. Li – в первой группе и у него на внешнем (последнем) энергетическом уровне один электрон, Be – во второй группе, у него на внешнем энергетическом уровне два электрона, у фтора – F – семь электронов на внешнем энергетическом уровне и он находится в седьмой группе.
Количество электронов на внешнем энергетическом уровне равно номеру группы (для элементов главных подгрупп).
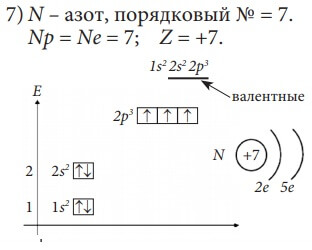
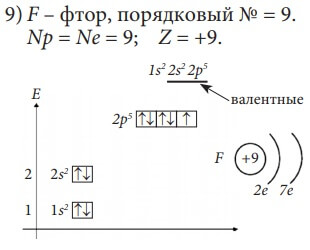
Введем понятие «валентные электроны» - это электроны, участвующие в образовании химических связей с другими атомами, в электронной формуле они подчеркнуты. Для элементов главных подгрупп валентными являются электроны внешнего энергетического уровня.
Используя правила, расположим электроны атома кремния по энергетическим уровням.
Si, порядковый № = 14. Элемент находится в III-ем периоде таблицы Д. И. Менделеева, следовательно, у него три энергетических уровня. Кремний располагается в главной подгруппе 4-й группы, поэтому на внешнем (третьем) энергетическом уровне у него 4 электрона. Так как кремний – элемент III-го периода, то первый и второй энергетический уровни у него уже заполнены максимально, то есть на первом уровне - два электрона, а на втором уровне – восемь электронов (см. таблицу 1).
Сравним строение атома Si (рис. 8) со строением атома C (рис. 7).
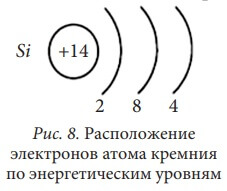
У них аналогичное строение внешней электронной оболочки, по четыре электрона у каждого элемента. Различие только в количестве электронных слоёв: у кремния их три, а у углерода – два. Эти два элемента называют электронными аналогами. Электронными аналогами являются и другие элементы, относящиеся к одной подгруппе:
Li, Na, K, Rb, Cs, все они имеют по одному электрону на внешнем энергетическом уровне, так как расположены в IA группе, а также
Be, Mg, Ca, Sr, Ba, имеющие по два электрона в наружном слое, так как расположены в IIA группе, и т.д.
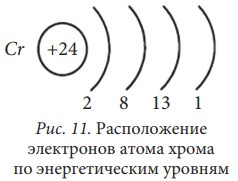
Рассмотрим строение электронной оболочки атома хрома. Его порядковый номер 24, следовательно Np = Ne = № порядковый = 24, заряд ядра Z = +24. Хром располагается в IV периоде, поэтому он имеет четыре энергетических уровня. Нарисуем энергетическую диаграмму, где укажем только орбитали четырех энергетических уровней и разместим на них 24 электрона, начиная с нижней 1s-орбитали и используя все правила заполнения, то есть пока не заполним орбитали с одинаковой энергией, не переходим к заполнению другой орбитали с более высокой энергией.
Последний электрон пришел на d-подуровень, следовательно, хром относится к d-элементам. Как видим, расположив электроны на орбиталях по всем правилам, на
3d-подуровне не хватает одного электрона до более устойчивого состояния атома, когда подуровень заполнен наполовину
поэтому в данном случае (а также в случае его электронного аналога молибдена -
Mo), наблюдается проскок электрона с ближайшего по энергии
s-подуровня на
d-подуровень. И это
основное состояние атома хрома, которое наиболее устойчиво и соответствует минимально возможному значению его энергии (см. рис. 10).
Электронные конфигурации атомов Cr и Mo:
Заметим, что 4s-подуровень ниже по энергии, чем 3d-подуровень, поэтому заполняется электронами раньше, но при написании электронной формулы атома принято все подуровни одного уровня сгруппировывать вместе:
Порядок заполнения орбиталей: …3s3p4s3d4p5s4d5p6s4f5d6p…
Порядок записи орбиталей в электронной формуле:
Складывая верхние индексы в электронной формуле атома хрома, отдельно для каждого энергетического уровня, получим расположение электронов по энергетическим уровням:
d-подуровень состоит из пяти орбиталей, на которых может разместиться 10 электронов, поэтому d-элементов всего 10 в каждом периоде, начиная с IV-го. В IV-ом периоде это элементы, начиная со скандия и заканчивая цинком. Все d-элементы находятся в побочных подгруппах, а s- и p-элементы – в главных подгруппах.
Для d-элементов валентными являются электроны внешнего энергетического уровня и предпоследнего уровня d-подуровня: 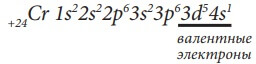
У хрома шесть валентных электронов и он располагается в шестой группе периодической системы элементов Д. И. Менделеева. Таким образом, количество валентных электронов равно номеру группы, в которой находится данный элемент(для всех элементов).
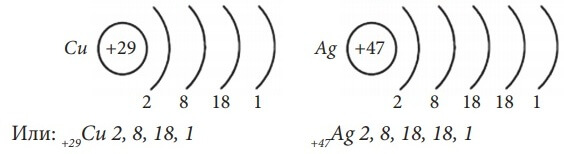
Рассмотрим строение электронной оболочки атома меди Cu. Порядковый номер 29. Np = Ne = № порядковый = 29. Z = +29. Cu – элемент IV-го периода, нарисуем энергетическую диаграмму, где укажем орбитали только четырех энергетических уровней. Разместим на них 29 электронов, пользуясь правилами заполнения орбиталей (см. рис. 12). На 3d-подуровне не хватает одного электрона до более устойчивого состояния атома, когда 3d-подуровень, а также третий энергетический уровень заполнены максимально. В данном случае, а также в случае электронных аналогов меди (атомов серебра Ag и золота Au) наблюдается
проскок электрона с ближайшего по энергии s-подуровня на d-подуровень. Истинное расположение электронов по орбиталям атома меди показано на рис. 13.
Электронные формулы атомов Cu и Ag в основном состоянии:
Последний электрон пришел на d-подуровень, поэтому Cu и Ag – d-элементы.
Расположим электроны атомов Cu и Ag по энергетическим уровням:
Таким образом, проскок электрона с внешнего s-подуровня на d-подуровень предпоследнего уровня наблюдается у атомов Cr, Mo, Cu , Ag, Au.
Задания для закрепления
30) Рассчитайте количество протонов, нейтронов и электронов для элементов III и IV периодов, составьте их электронные формулы, подчеркните их валентные электроны, распределите электроны по энергетическим уровням, а валентные электроны – по орбиталям. Определите, к какому семейству элементов (s-, p-, d- или f-) относится каждый элемент.
31) Число энергетических уровней и число внешних электронов атома Br равны соответственно:
1) 5,5 2) 5,7 3) 4,7 4) 4,5
Укажите номер правильного ответа (одна цифра).
32) Четыре валентных электрона имеет атом:
1) B 2) Ti 3) S 4) Cu
Укажите номер правильного ответа (одна цифра).
33) Электронную формулу 1s22s22p63s23p63d104s2 имеет атом:
1) Ca 2) Ti 3) Ge 4) Zn
Укажите номер правильного ответа (одна цифра).
34) Окончание электронной формулы …3d54s2 соответствует атому:
1) Br 2) Ca 3) Mn 4) Zn
Укажите номер правильного ответа (одна цифра).
35) Установите соответствие между элементом и электронной конфигурацией атома:
Элемент Электронная конфигурация
1) Ne А) 1s22s2
2) O Б) 1s22s22p3
3) Be В) 1s22s22p6
4)
N Г)
1s22s22p4
Ответ:
К каждой позиции, обозначенной цифрой, выберите позицию, обозначенную буквой. Например, в ответе нужно записать АВГБ.
36) Число электронов внешнего электронного слоя атома P равно:
1) 5 2) 6 3) 3 4) 15
Укажите номер правильного ответа (одна цифра).
37) Электронную конфигурацию внешнего электронного слоя 4s24p4 имеет атом:
1) Se 2) Ge 3) Cr 4) Ti
Укажите номер правильного ответа (одна цифра).
38) Сходную конфигурацию внешнего энергетического уровня имеют атомы O и:
1) Mg 2) Se 3) Ne 4) N
Укажите номер правильного ответа (одна цифра).
39) Порядковый номер элемента, электронное строение атома которого 1s22s22p63s23p2:
1) 12 2) 14 3) 11 4) 16
Укажите номер правильного ответа (одна цифра).
40) Электронная конфигурация валентных электронов атома хрома:
1) 3d44s2 2) 3s23p4 3) 3d24s2 4) 3d54s1
Укажите номер правильного ответа (одна цифра).
41) Определите, у атомов каких элементов валентные электроны находятся как на s, так и на d-подуровне:
1)
Si 2)
Cr 3)
C 4)
Pb 5)
Cu
Ответ:

Укажите номера правильных ответов (две цифры).
42) Определите, у атомов каких элементов на внешнем энергетическом уровне содержится два электрона в основном состоянии атома:
1)
Cl 2)
Mn 3)
Ba 4)
Cr 5)
C
Ответ:

Укажите номера правильных ответов (две цифры).
43) Определите, какие атомы имеют одинаковую конфигурацию внешнего энергетического уровня:
1)
Rb 2)
Cr 3)
Ca 4)
Si 5)
S
Ответ:

Укажите номера правильных ответов (две цифры).
44) Из указанного перечня выберите два элемента, атомы которых имеют электронную формулу внешнего энергетического уровня ns2np5:
1)
Mg 2)
Mn 3)
F 4)
P 5)
Br
Ответ:

Укажите номера правильных ответов (две цифры).
45) Атомы каких элементов имеют 5 валентных электронов:
1)
As 2)
Mn 3)
Cl 4)
V 5)
Cr
Ответ:

Укажите номера правильных ответов (две цифры).
46) Из указанного перечня выберите два элемента, которые принадлежат семейству p-элементов:
1)
Ca 2)
Zn 3)
Pb 4)
Al 5)
He
Ответ:

Укажите номера правильных ответов (две цифры).
47) Из указанного перечня выберите два элемента, у атомов которых валентные электроны находятся как на s-, так и на d-подуровнях:
1)
Mn 2)
Sn 3)
Br 4)
Ba 5)
Fe
Ответ:

Укажите номера правильных ответов (две цифры).
§1.5. s-, p-, d- и f-элементы. Запись электронной формулы атома по таблице Д. И. Менделеева.
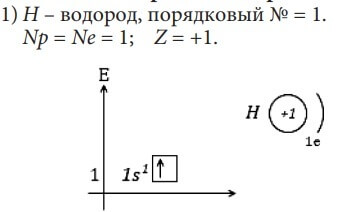
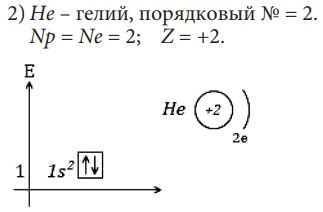
Так как s-подуровень есть на каждом энергетическом уровне, то и s-элементы есть в каждом периоде. Они находятся в начале периода. На s-подуровне - одна орбиталь, то есть два электрона, следовательно, s-элементов в каждом периоде тоже два. В цветной таблице они обычно выделены желтым цветом: H и He, Li и Be, Na и Mg, K и Ca, Rb и Sr, Cs и Ba, Fr и Ra. H и He – в I-м периоде, у них заполняется 1s-орбиталь, Li и Be – во II-м периоде, у них идет заполнение 2s-орбитали, и т.д.
P-подуровень есть на всех энергетических уровнях, кроме первого, следовательно, p-элементы есть в каждом периоде, кроме первого, и расположены они в конце периода, всего в каждом периоде их шесть (по максимальному количеству электронов, содержащихся на p-подуровне). Например, N - p-элемент II-го периода, у него заполняется 2p-орбиталь, Cl - p-элемент III-го периода, у него заполняется 3p-орбиталь. Р-элементы в цветной таблице этой книги выделены розовым цветом. S- и p-элементы располагаются в главных подгруппах, d-элементы – в побочных подгруппах. d-элементы в таблице Д. И. Менделеева впервые появляются в IV-м периоде после s-элементов K и Ca, так как согласно принципу наименьшей энергии (см. рис. 5) сначала заполняется электронами 4s-подуровень (у K и Ca), а затем 3d-подуровень (у Sc, Ti, V, Cr, Mn, Fe, Co , Ni , Cu, Zn). d-орбиталей всего пять на каждом энергетическом уровне, начиная с третьего, на них может разместиться максимум 10 электронов, поэтому d-элементов также 10. В V-м периоде у элементов Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd, Ag и Cd идет заполнение 4d-подуровня. В VI-м периоде у элементов La, Hf, Ta, W, Re, Os, Ir, Pt, Au, Hg заполняется 5d-подуровень. d-элементы в цветной таблице этой книги выделены сиреневым цветом.
Зная, где расположены s-, p-, d- и f-элементы в таблице Менделеева, можно записать порядок заполнения орбиталей любого атома. Рассмотрим атом ванадия V. Идем по таблице Д. И. Менделеева в порядке возрастания атомного номера.

Таким образом, порядок заполнения электронных орбиталей атома V: 1s22s22p63s23p64s23d3.
Запишем электронную формулу V, объединяя орбитали одного энергитечского уровня 3s, 3p и 3d-орбитали:
+23V1s22s22p63s23p63d34s2
На экзамене дается черно-белая таблица Д. И. Менделеева, но думаю, вы легко перейдете от цветной к черно-белой, так как, пока изучаете химию, вам часто придется пользоваться таблицей и вы запомните
расположение в ней s-, p-, d-, f-элементов.
Задания для закрепления
48) Запишите электронные формулы атомов Mn, Cu, Zn, Se, Rb, Y, Mo не пользуясь энергетической диаграммой, а только таблицей Д. И. Менделеева. Определите, к какому семейству элементов принадлежат эти атомы, подчеркните их валентные электроны, расположите электроны по энергетическим уровням, а валентные электроны - по орбиталям.
§1.6. Основное и возбужденное состояния атома.
Если электронная орбиталь заполнена, то, согласно принципа Паули, на ней может находиться два электрона с разными спинами

. Эти электроны называют спаренными. В случае нахождения на орбитали одного электрона такой электрон называется неспаренным:

.
Атомы могут находиться в основном и возбужденном состояниях. В основном состоянии энергия атома минимальна, и электроны занимают орбитали согласно принципу наименьшей энергии, принципу Паули и правилу Хунда. Любое другое состояние атома является возбуждённым, неустойчивым: из него электрон самопроизвольно переходит в состояние с более низкой энергией. Нас интересует возбуждённое состояние атома, при котором валентные спаренные электроны распариваются в
пределах этого же энергетического уровня.
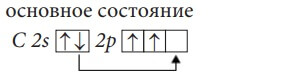
Рассмотрим атом углерода, его электронная конфигурация
1s22s22p2, расположение валентных электронов по орбиталям 2
s
2
p
.
В основном состоянии атом углерода имеет два неспаренных электрона, а в возбужденном состоянии – четыре.
Атом кремния – электронный аналог атома углерода, у него аналогичная электронная конфигурация внешнего электронного слоя:
У атома азота в основном состоянии также имеется одна пара спаренных электронов
N … 2s22p3 2s 2p
2p
Но распариваться эта пара не может, так как свободных орбиталей
на втором энергетическом уровне больше нет, а орбитали третьего энергетического уровня очень сильно различаются по энергии с орбиталями второго уровня, затраты на возбуждение электрона на третий энергетический уровень не компенсируются энергией образования новых связей, такой процесс в целом оказывается энергетически не выгодным, поэтому у атома азота нет возбужденного состояния, приводящего к увеличению числа возможных химических связей.
Электронный аналог азота, атом фосфора, в отличие от атома азота имеет свободные 3d -орбитали, куда возможно распаривание электронов:
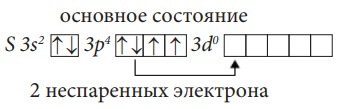
У атома серы S возможны два возбужденных состояния, так как в основном состоянии у него две пары спаренных электронов и на третьем (внешнем) энергетическом уровне имеется свободный d-подуровень:
Задания для закрепления
49) Определите количество неспаренных электронов в основном и возбужденном состояниях атомов B, O, Cl, F, As, Se.
50) Определите, атомы каких элементов в основном состоянии имеют наименьшее число неспаренных электронов на внешнем энергетическом уровне:
1) Si 2) Cr 3) C 4) Pb 5) Cu
Ответ:

Укажите два номера правильных ответов (две цифры).
51) Атомы каких элементов в возбуждённом состоянии могут иметь 4 неспаренных электрона:
1) S 2) Zn 3) Sn 4) Cr 5) O
Ответ:

Укажите два номера правильных ответов (две цифры).
52) Два неспаренных p-электрона в основном состоянии содержат атомы:
1) Ti 2) As 3) Pb 4) S 5) I
Ответ:

Укажите два номера правильных ответов (две цифры).
53) Из указанных в ряду химических элементов выберите три элемента, атомы которых в максимально возбуждённом состоянии имеют 4 и более неспаренных электрона. Расположите выбранные элементы в порядке увеличения числа неспаренных электронов. Запишите в поле ответа номера выбранных элементов в нужной последовательности:
1) N 2) P 3) Br 4) O 5) S
Ответ:

Укажите три номера правильных ответов в нужной последовательности (три цифры).
54) Атомы каких элементов не имеют валентных p-электронов в основном состоянии:
1) Al 2) Pb 3) Zn 4) Fe 5) Br
Ответ:

Укажите два номера правильных ответов (две цифры).
55) Из предложенного перечня выберите два элемента, атомы которых в максимально возбуждённом состоянии имеют 6 неспаренных электронов:
1) Cr 2) S 3) O 4) Se 5) Mg
Ответ:

Укажите два номера правильных ответов (две цифры).
56) Наименьшее число неспаренных электронов имеют атомы в основном состоянии:
1) C 2) F 3) N 4) S 5) K
Ответ:

Укажите два номера правильных ответов (две цифры).
§1.7. Периодичность свойств атомов. Радиус атома. Энергия ионизации.
Вследствие волновой природы электронов атомы не имеют определенных границ. Условно за радиус атома можно принять положение (относительно ядра) максимума плотности его внешнего электронного слоя. Строение атома таково, что ядро очень маленькое (диаметр ~10-13 см) и тяжелое, а электронная оболочка легкая и огромная (размер атома ~10-8 см), то есть электронная оболочка примерно в 100 000 раз больше ядра, следовательно, расстояние между электронными слоями велико и может сокращаться при определенных условиях.
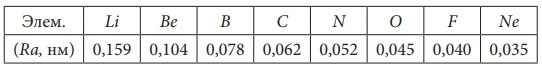
Рассмотрим радиусы атомов (Ra) элементов II-го периода:
Табл. 2. Значения орбитальных радиусов атомов элементов II-го периода.
У всех атомов два электронных слоя. Но у Li 3 протона в ядре и 3 электрона в электронной оболочке, а у
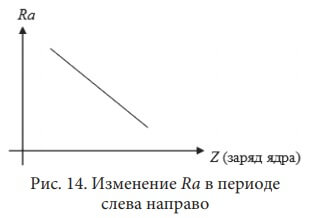
Be соответственно 4 протона и 4 электрона. У бора 5 протонов и 5 электронов, и т.д. Чем больше заряд ядра, тем сильнее притяжение электронов к нему. Под действием этого притяжения атом как бы «сжимается», расстояние между электронными слоями уменьшается.
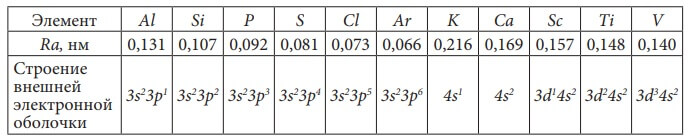
То есть с увеличением заряда ядра в периоде (слева направо) радиус атома (Ra) уменьшается:У элементов IА группы Li, Na, K, Rb, Cs, Fr с увеличением заряда ядра в подгруппе (сверху вниз) радиус атома увеличивается. Эта же закономерность наблюдается у элементов всех главных подгрупп:
Табл. 3. Значение орбитальных радиусов атомов некоторых элементов главных подгрупп.
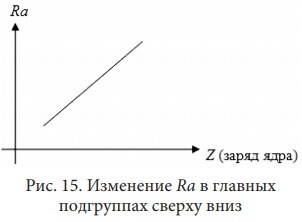
Такое увеличение объясняется тем, что при неизменной внешней оболочке атома у каждого следующего элемента (
Li  Na
Na  K
K) на один электронный слой больше. Так как расстояние между электронными слоями огромное, то с появлением нового электронного слоя радиус атома резко возрастает (см. рис. 15)
Если расположить все элементы в порядке возрастания заряда ядра их атомов, то увидим, что периодически повторяется строение внешней электронной оболочки атомов (Д. И. Менделеев расставил элементы в порядке возрастания атомных масс): у Li, Na, K, Rb, Cs (элементов IА группы) электронная конфигурация внешнего электронного уровня ns1, где n – номер энергетического уровня; у Be, Mg, Ca, Sr, Ba (элементов IIА группы) электронная конфигурация ns2; у B, Al, Ga, In, Tl (элементов IIIА группы) электронная конфигурация ns2np1, и т.д. Всего получается восемь главных подгрупп элементов.
Сходство в строении внешней электронной оболочки ведет к сходству в свойствах элементов (в данном случае – к сходству в радиусах атомов Ra).
У элементов Li, Na, K, … (IA группа) сходны внешние электронные оболочки атомов (ns1) и самые большие радиусы атомов. В периодах с увеличением числа электронов при неизменном n уменьшается радиус атома Ra.
У элементов Ne, Ar, Kr,… (VIIIA группа) одинакова электронная конфигурация внешнего энергетического уровня ns2np6 и они имеют самые маленькие радиусы атомов.
Таблица 4. Периодическое изменение строения внешней электронной оболочки и радиуса атомов.
Так проявляется периодический закон, открытый Д. И. Менделеевым 1 марта 1869 года, который в настоящее время формулируется так:
 Свойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от величины заряда ядра их атомов.
Свойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от величины заряда ядра их атомов.
Периодически изменяются и другие свойства элементов, например, энергия ионизации.
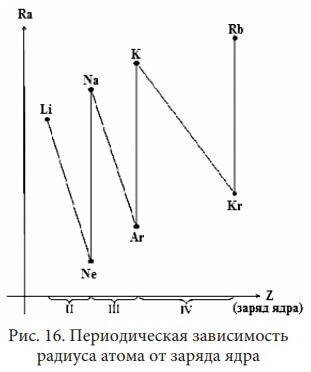
Энергия ионизации (Eи) – энергия, необходимая для отрыва от атома наиболее слабо связанного электрона. Например, атом Na имеет большой радиус (см. описание и рис. 16). Его валентный электрон слабо связан с ядром, поэтому легко отрывается, то есть на отрыв электрона необходимо затратить незначительное количество энергии.
Чем больше радиус атома Ra, тем слабее валентные электроны связаны с ядром, тем легче они отрываются от атома, тем меньшей энергией ионизации они обладают. Так как радиус атома изменяется периодически – в зависимости от Z (заряда ядра), то и Eи изменяется периодически.
Наименьшей энергией ионизации обладают элементы IA группы, наибольшей – элементы VIIIА группы.
§1.8. Благородные газы. Восстановительные и окислительные свойства атомов. Ионы. Металлы, амфотерные и переходные металлы, неметаллы.
Каждый период в таблице Д. И. Менделеева заканчивается благородным (или инертным) газом: He, Ne, Ar, Kr, Xe, Rn. Эти элементы относятся к VIIIА группе. Гелий имеет максимально возможное для первого энергетического уровня количество электронов – два. Остальные элементы имеют электронную конфигурацию внешнего электронного слоя ns2np6, то есть восемь электронов на внешнем энергетическом уровне. Название свое – «благородные» - они получили благодаря своей инертности в химических свойствах: гелий, неон и аргон не образуют соединений валентного типа; Kr, Xe и Rn образуют соединения только со фтором и кислородом, очень активными элементами. Исходя из инертности элементов VIIIА группы был сделан вывод об устойчивости атомов с восьмиэлектронной внешней оболочкой (и двухэлектронной у гелия). Все другие атомы, стремясь к устойчивости, отдают или принимают электроны, приобретая восьмиэлектронную внешнюю оболочку.
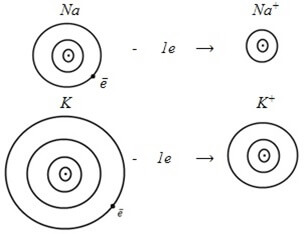
Например, атом натрия имеет один валентный электрон, слабо связанный с ядром вследствие большого радиуса. Он легко теряет его, и внешний электронный слой становится таким же восьмиэлектронным, как у атома неона.
У частицы, потерявшей один электрон, электронов стало на один меньше, чем протонов, поэтому она заряжена положительно и называется катионом (Na+). Электрически заряженные частицы, образовавшиеся из атомов (или атомных групп) вследствие потери или присоединения электронов, называются ионами.
 Свойство атомов отдавать электроны – свойство восстановителя
Свойство атомов отдавать электроны – свойство восстановителя (восстановительное свойство).
Na – восстановитель. Чем больше радиус атома, тем слабее его валентные электроны связаны с ядром, тем легче такие атомы теряют электроны, тем сильнее их восстановительные свойства. Самый сильный восстановитель –
Fr, так как его радиус наибольший. Так как
Ra (K) > Ra (Na), то
K легче теряет электрон, следовательно, его восстановительные свойства выше, чем у натрия.
Так как радиус атома изменяется периодически в зависимости от заряда ядра, то и восстановительные свойства элементов изменяются периодически (периодами). В периодах слева направо радиус атома Ra уменьшается, восстановительные свойства атомов также уменьшаются. В подгруппах сверху вниз Ra увеличивается, восстановительные свойства атомов возрастают. Атом фтора, имеющий самый маленький Ra, восстановительными свойствами не обладает.
Мы рассматривали свойства отдельных атомов отдавать электроны (восстановительные свойства).
Если взять простое вещество Na, построенное из множества одинаковых атомов натрия, то свойство этого вещества отдавать электроны определяет его свойство как металла. Металлы – твердые при комнатной температуре вещества (исключение – ртуть, жидкий металл), обладают металлическим блеском, тепло- и электропроводностью, ковкостью, пластичностью и сильными восстановительными свойствами.
Чем сильнее восстановительные свойства атомов элемента, тем более металлическими свойствами обладает вещество металл, образованное атомами этого элемента.
Элементы IV-го периода K, Ca, Sc образуют простые вещества металлы. Радиусы их атомов от K к Sc уменьшаются, восстановительные свойства в этом ряду также уменьшаются, металлические свойства простых веществ, образованных атомами данных элементов, также уменьшаются.
Элементы
Li, Na, K, Rb, Cs, Fr – элементы IА группы, образуют группу щелочных металлов. В группе сверху вниз радиус атома
Ra увеличивается, следовательно, увеличивается способность отдачи валентного электрона (значит, уменьшается энергия ионизации – энергия, затрачиваемая на отрыв электрона от атома), следовательно, увеличивается восстановительная способность атомов и металлические свойства простых веществ, образованных этими атомами.
То же самое можно сказать про щелочноземельные металлы и Mg, элементы IIA группы: Mg, Ca, Sr, Ba. В этом ряду Ra увеличивается, энергия ионизации уменьшается, восстановительные и металлические свойства усиливаются.
Элементы, образующие простые вещества металлы, имеют самые большие радиусы атомов и в таблице Д. И. Менделеева располагаются в начале каждого периода (слева и внизу): Li, Na, Mg, K, Ca, Sc, Rb, Sr, Y, In, Cs, Ba, лантаноиды, Tl, Fr, Ra, актиноиды, а также Cu, Ag, Ni.
Рассмотрим элемент хлор. Он расположен в конце III-го периода в таблице Д. И. Менделеева, следовательно, его атом обладает малым радиусом. Семь его валентных электронов хорошо притянуты к ядру и до восьмиэлектронной внешней оболочки не хватает одного электрона. Вследствие малого радиуса атом хлора легко присоединяет один электрон и становится устойчивым, как аргон:
Присоединив электрон, атом превращается в отрицательно заряженную частицу – анион, электронная конфигурация которого 1s22s22p63s23p6 такая же, как у атома аргона.
Свойство атома присоединять электроны – свойство окислителя (окислительное свойство). Так как наименьший радиус имеет атом фтора F (не считая элементы VIIIА группы, у которых электронная оболочка завершена и поэтому их окислительные и восстановительные способности равны нулю), то фтор – самый сильный окислитель из всех элементов.
Окислительными свойствами обладают элементы, которые образуют простые вещества – неметаллы, они расположены в верхней и правой частях таблицы Д. И. Менделеева:
H, B , C, N, O, F, Si, P, S, Cl, As, Se , Br, Te, I, At. Эти же элементы (кроме фтора) могут проявлять и восстановительные свойства.
Между элементами-металлами, расположенными в начале каждого периода, и элементами-неметаллами, находящимися в конце каждого периода, расположены амфотерные элементы, обладающие свойствами металлов и неметаллов. Граница, отделяющая неметаллы от амфотерных элементов и металлов проходит по линии: Be (элемент II-го периода 2А группы) – Al (элемент III-го периода 3А группы) – Ge (IV период, 4А группа) – Sb (V-ый период, 5А группа) – Po (VI-ой период, 6А группа). Справа от этих элементов находятся неметаллы, а слева либо металлы (Li, Mg), либо амфотерные элементы (Sn, Pb, Bi).
d-элементы от Ti до Zn относятся к переходным металлам, им присущи только восстановительные свойства, их атомы не могут принимать электроны.
Деление на металлы, неметаллы и амфотерные элементы относительно. Так, углерод относят к элементам неметаллам, хотя простое вещество графит, образованное атомами углерода, по физическим свойствам напоминает металл: имеет металлический блеск, электро- и теплопроводен. Основные признаки деления простых веществ на металлы, неметаллы и амфотерные даны в главе III.
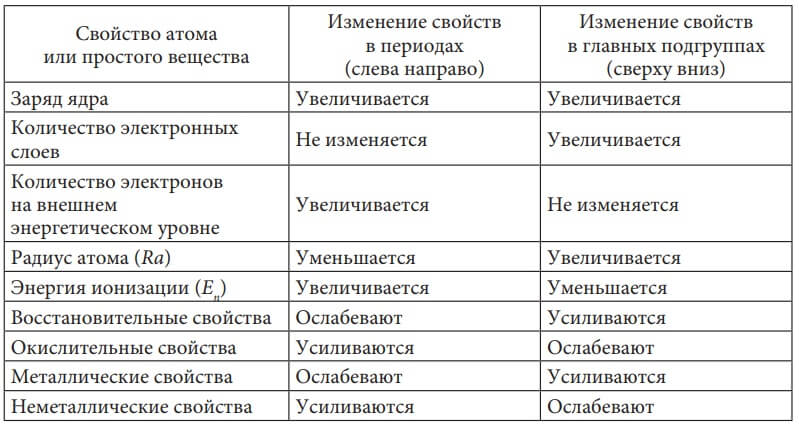
В таблице 5 показано изменение свойств атомов и простых веществ, образованных ими, в периодах и группах.
Таблица 5. Изменение свойств атомов и простых веществ, ими образованных, в периодах и группах
Задания для закрепления
57) Притяжение электронов внешнего слоя к ядру увеличивается в ряду:
1) Br – Se – As
2) C – Si – P
3) O – S – Se
4) Br – Cl – F
Укажите один номер правильного ответа (одна цифра).
58) У Mg и Ca одинаковы:
1) Заряды ядер атомов;
2) Количество электронных слоев;
3) Количество валентных электронов;
4) Радиусы атомов;
Укажите один номер правильного ответа (одна цифра).
59) Притяжение электронов внешнего слоя к ядру ослабевает в ряду:
1) Li – Na – K
2) Ca – Mg – Be
3) Si – P – S
4) Br – Se – S
Укажите один номер правильного ответа (одна цифра).
60) У Cs и Ba одинаковы:
1) Радиусы атомов;
2) Число электронных слоев;
3) Энергия ионизации;
4) Число валентных электронов;
Укажите один номер правильного ответа (одна цифра).
61) У Cs и Rb одинаковы:
1) Число электронов на внешнем энергетическом уровне;
2) Заряды ядер;
3) Число энергетических уровней;
4) Радиусы атомов;
Укажите один номер правильного ответа (одна цифра).
1) Увеличивается число электронных слоев;
2) Уменьшается энергия ионизации атомов;
3) Ослабевают неметаллические свойства;
4) Уменьшается радиус атома;
Укажите один номер правильного ответа (одна цифра).
63) Наибольший радиус имеет атом:
1) Be
2) Ba
3) Sr
4) Mg
Укажите один номер правильного ответа (одна цифра).
64) Неметаллические свойства наиболее выражены у:
1) Селена
2) Фосфора
3) Хлора
4) Брома
Укажите один номер правильного ответа (одна цифра).
65) Легче всего присоединяет электроны атом:
1) Хлора
2) Брома
3) Селена
4) Мышьяка
Укажите один номер правильного ответа (одна цифра).
66) В ряду
Si  P
P  S
S  Cl
Cl происходит:
1) Увеличение заряда ядра атомов;
2) Уменьшение числа электронных слоев;
3) Уменьшение силы притяжения валентных электронов к ядру;
4) Увеличение радиуса атомов;
Укажите один номер правильного ответа (одна цифра).
67) Только восстановительными свойствами обладает:
1) Алюминий
2) Кремний
3) Фосфор
4) Сера
Укажите один номер правильного ответа (одна цифра).
68) Большинство неметаллов относится к семейству:
1) s-элементов
2) p-элементов
3) d-элементов
4) f-элементов
Укажите один номер правильного ответа (одна цифра).
69) Наибольшую энергию нужно затратить на отрыв электрона от атома:
1) Теллура
2) Селена
3) Серы
4) Кислорода
Укажите один номер правильного ответа (одна цифра).
70) Наименьшую энергию нужно затратить на отрыв электрона от атома:
1) Селена
2) Серы
3) Хлора
4) Брома
Укажите один номер правильного ответа (одна цифра).
71) Усиление окислительных свойств происходит в ряду:
1) C – Si
2) S – Se
3) P – S
4) P – Si
Укажите один номер правильного ответа (одна цифра).
72) Наиболее выражены окислительные свойства у атома:
1) Фтора
2) Брома
3) Йода
4) Бора
Укажите один номер правильного ответа (одна цифра).
73) Окислительными свойствами не обладают атомы:
1) Углерода
2) Скандия
3) Йода
4) Фосфора
Укажите один номер правильного ответа (одна цифра).
74) Установите соответствие между частицей и ее электронной конфигурацией:
| Частица | Электронная конфигурация |
| 1) S+4 | А) 1s22s22p63s2 |
| 2) S+6 | Б) 1s22s22p6 |
| 3) N-3 | В) 1s22s22p63s23p6 |
| 4) S0 | Г) 1s22s22p63s23p4 |
Ответ: 
К каждой позиции, обозначенной цифрой, выберите позицию, обозначенную буквой. Например, в ответе нужно записать АВГБ.
75) Установите соответствие между частицей и ее электронной конфигурацией:
| Частица | Электронная конфигурация |
| 1) P+5 | А) 1s22s22p63s23p6 |
| 2) Cl+7 | Б) 1s22s22p6 |
| 3) S0 | В) 1s22s22p63s1 |
| 4) Cl-1 | Г) 1s22s22p63s23p4 |
Ответ: 
К каждой позиции, обозначенной цифрой, выберите позицию, обозначенную буквой. Например, в ответе нужно записать АВГБ.
76) Определите, ионы каких из указанных элементов могут иметь электронную формулу, совпадающую с электронной формулой атома неона:
1)
Al 2)
Cr 3)
C 4)
Pb 5)
Cu
Ответ:

Укажите два номера правильных ответов (две цифры).
77) Электронную конфигурацию инертного газа аргона имеют частицы:
1)
N3- 2)
Al 3)
Ca2+ 4)
P3+ 5)
Cl-
Ответ:

Укажите два номера правильных ответов (две цифры).
78) Одинаковое число электронов имеют частицы:
1)
N3- 2)
Mg 3)
Ca2+ 4)
P3+ 5)
Cr3+
Ответ:

Укажите два номера правильных ответов (две цифры).
79) Из предложенного перечня выберите три элемента, которые в периодической таблице Д.И. Менделеева находятся в одной группе. Запишите номера выбранных элементов в порядке усиления их неметаллических свойств:
1)
Si 2)
Cr 3)
C 4)
Pb 5)
Cu
Ответ:

Укажите три номера правильных ответов (три цифры).
80) Из предложенного перечня выберите три элемента-металла. Запишите номера выбранных элементов в порядке увеличения числа их валентных электронов:
1)
Si 2)
Ti 3)
Se 4)
Be 5)
Cr
Ответ:

Укажите три номера правильных ответов (три цифры).
81) Из предложенного перечня выберите три элемента-металла. Запишите номера выбранных элементов в порядке уменьшения числа неспаренных электронов в основном состоянии их атомов:
1)
Sn 2)
B 3)
Fe 4)
As 5)
Cr
Ответ:

Укажите три номера правильных ответов (три цифры).
82) Из предложенного перечня выберите три элемента, которые в периодической системе Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке ослабления их металлических свойств:
1)
Ca 2)
C 3)
Ge 4)
Si 5)
K
Ответ:

Укажите три номера правильных ответов (три цифры).
83) Из предложенного перечня выберите три элемента-неметалла. Расположите выбранные элементы в порядке увеличения радиуса их атомов:
1)
C 2)
Al 3)
Si 4)
N 5)
Be
Ответ:

Укажите три номера правильных ответов (три цифры).
КУПИТЬ






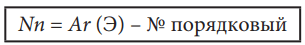
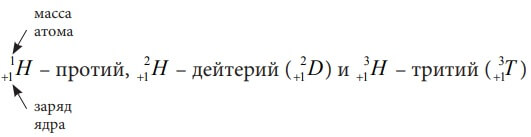
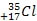 и
и 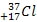 . Массовая доля атомов 35Cl составляет ~ 75%, а массовая доля 37Cl ~ 25%. Средняя относительная атомная масса получается дробной:
. Массовая доля атомов 35Cl составляет ~ 75%, а массовая доля 37Cl ~ 25%. Средняя относительная атомная масса получается дробной:
 ».
». » (движение электрона по часовой стрелке вокруг своей оси) или «
» (движение электрона по часовой стрелке вокруг своей оси) или « » (против часовой стрелки).
» (против часовой стрелки). - правильно,
- правильно,  - неправильно.
- неправильно.
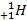
 .
.

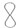 2)
2)  3)
3)  4)
4) 
 3)
3)  4)
4) 
 2)
2)  3)
3)  4)
4) 
 2)
2)  3)
3)  4)
4)  5)
5) 





 - правильно,
- правильно,  - неправильно.
- неправильно.



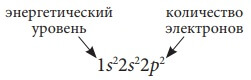 - это электронная формула атома углерода, или электронная конфигурация, третий способ изображения строения атома. Расшифровывается так: на первом энергетическом уровне на s-подуровне имеется два электрона, на втором энергетическом уровне на s-подуровне располагаются два электрона, на втором энергетическом уровне на p-подуровне находятся два электрона. Объединив электроны каждого энергетического уровня (складывая верхние индексы), получим расположение электронов по энергетическим уровням:
- это электронная формула атома углерода, или электронная конфигурация, третий способ изображения строения атома. Расшифровывается так: на первом энергетическом уровне на s-подуровне имеется два электрона, на втором энергетическом уровне на s-подуровне располагаются два электрона, на втором энергетическом уровне на p-подуровне находятся два электрона. Объединив электроны каждого энергетического уровня (складывая верхние индексы), получим расположение электронов по энергетическим уровням:



 У них аналогичное строение внешней электронной оболочки, по четыре электрона у каждого элемента. Различие только в количестве электронных слоёв: у кремния их три, а у углерода – два. Эти два элемента называют электронными аналогами. Электронными аналогами являются и другие элементы, относящиеся к одной подгруппе: Li, Na, K, Rb, Cs, все они имеют по одному электрону на внешнем энергетическом уровне, так как расположены в IA группе, а также Be, Mg, Ca, Sr, Ba, имеющие по два электрона в наружном слое, так как расположены в IIA группе, и т.д.
У них аналогичное строение внешней электронной оболочки, по четыре электрона у каждого элемента. Различие только в количестве электронных слоёв: у кремния их три, а у углерода – два. Эти два элемента называют электронными аналогами. Электронными аналогами являются и другие элементы, относящиеся к одной подгруппе: Li, Na, K, Rb, Cs, все они имеют по одному электрону на внешнем энергетическом уровне, так как расположены в IA группе, а также Be, Mg, Ca, Sr, Ba, имеющие по два электрона в наружном слое, так как расположены в IIA группе, и т.д.


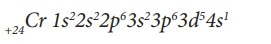
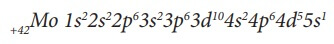


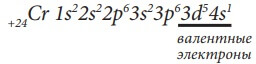


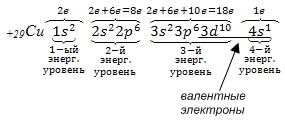
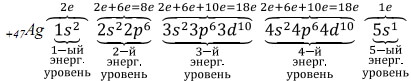









 . Эти электроны называют спаренными. В случае нахождения на орбитали одного электрона такой электрон называется неспаренным:
. Эти электроны называют спаренными. В случае нахождения на орбитали одного электрона такой электрон называется неспаренным:  .
. 2p
2p .
.

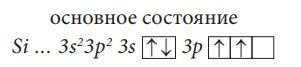

 2p
2p











 У всех атомов два электронных слоя. Но у Li 3 протона в ядре и 3 электрона в электронной оболочке, а у Be соответственно 4 протона и 4 электрона. У бора 5 протонов и 5 электронов, и т.д. Чем больше заряд ядра, тем сильнее притяжение электронов к нему. Под действием этого притяжения атом как бы «сжимается», расстояние между электронными слоями уменьшается. То есть с увеличением заряда ядра в периоде (слева направо) радиус атома (Ra) уменьшается:
У всех атомов два электронных слоя. Но у Li 3 протона в ядре и 3 электрона в электронной оболочке, а у Be соответственно 4 протона и 4 электрона. У бора 5 протонов и 5 электронов, и т.д. Чем больше заряд ядра, тем сильнее притяжение электронов к нему. Под действием этого притяжения атом как бы «сжимается», расстояние между электронными слоями уменьшается. То есть с увеличением заряда ядра в периоде (слева направо) радиус атома (Ra) уменьшается: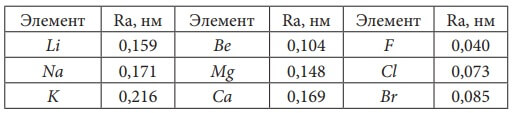
 Такое увеличение объясняется тем, что при неизменной внешней оболочке атома у каждого следующего элемента (Li
Такое увеличение объясняется тем, что при неизменной внешней оболочке атома у каждого следующего элемента (Li  Na
Na  K) на один электронный слой больше. Так как расстояние между электронными слоями огромное, то с появлением нового электронного слоя радиус атома резко возрастает (см. рис. 15)
K) на один электронный слой больше. Так как расстояние между электронными слоями огромное, то с появлением нового электронного слоя радиус атома резко возрастает (см. рис. 15) 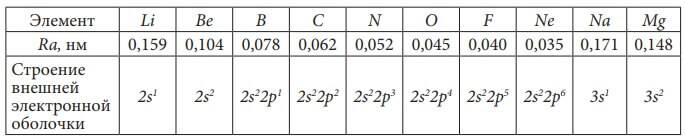
 Свойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от величины заряда ядра их атомов.
Свойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от величины заряда ядра их атомов.
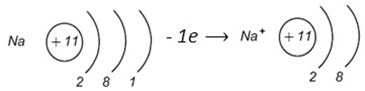

 Свойство атомов отдавать электроны – свойство восстановителя (восстановительное свойство). Na – восстановитель. Чем больше радиус атома, тем слабее его валентные электроны связаны с ядром, тем легче такие атомы теряют электроны, тем сильнее их восстановительные свойства. Самый сильный восстановитель – Fr, так как его радиус наибольший. Так как Ra (K) > Ra (Na), то K легче теряет электрон, следовательно, его восстановительные свойства выше, чем у натрия.
Свойство атомов отдавать электроны – свойство восстановителя (восстановительное свойство). Na – восстановитель. Чем больше радиус атома, тем слабее его валентные электроны связаны с ядром, тем легче такие атомы теряют электроны, тем сильнее их восстановительные свойства. Самый сильный восстановитель – Fr, так как его радиус наибольший. Так как Ra (K) > Ra (Na), то K легче теряет электрон, следовательно, его восстановительные свойства выше, чем у натрия.

 Si
Si  P
P  S
S P
P  S
S  Cl происходит:
Cl происходит: 








