ПЕРЕХОДИТЕ НА НАШ НОВЫЙ САЙТ
ГЛАВА 2. ХИМИЧЕСКАЯ СВЯЗЬ
§2.1. Ионная связь
Причиной, по которой одни атомы взаимодействуют с другими, является стремление к устойчивости, а в итоге – к минимуму энергии. Атомы стремятся приобрести восьмиэлектронную оболочку благородных газов. При взаимодействии атомов металлов с атомами неметаллов происходит полная передача валентных электронов от атома металла, легко теряющего электроны, к атому неметалла, способного присоединять электроны, и образуются противоположно заряженные ионы. Например, атомы натрия и хлора имеют электронные конфигурации:
Обозначим валентные электроны точками:

Электронная схема образования NaCl:
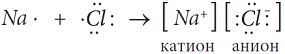
Атом металла Na отдал валентный электрон атому хлора и оба атома при этом приобрели устойчивую внешнюю электронную оболочку благородных газов неона Ne и аргона Ar:
Как известно из физики, противоположно заряженные частицы притягиваются друг к другу и оказываются связанными друг с другом. Так возникает химическая связь, называемая ионной.
Химическая связь, образованная путем электростатического притяжения катионов и анионов, называется ионной.
Ион можно упрощенно представить в виде заряженного шарика, который любой точкой своей поверхности способен притянуть ион противоположного заряда, то есть один ион может притянуть столько противоположно заряженных ионов, сколько позволит его поверхность и даже больше; может образоваться второй, третий и последующие слои противоположно заряженнных ионов. Но с расстоянием сила притяжения уменьшается, связь с дальними ионами менее прочная, чем с первым слоем ионов. Из вышесказанного следует, что ионная связь не имеет направления (ненаправлена) и ненасыщаема.
В случае образования молекулы MgCl2, атом магния, чтобы стать устойчивым, отдает два своих валентных электрона двум атомам хлора и превращается в двухзарядный катион:
Электронная схема образования MgCl2:
Рассмотрим образование молекулы MgO.
Расположение валентных электронов атома O:
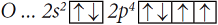
Атому кислорода не хватает двух электронов до устойчивой восьмиэлектронной оболочки. Забирая их у атома магния, он превращается в двухзарядный анион. С магнием кислород образует ионную химичес
кую связь по схеме:
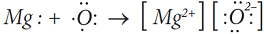
Вещества NaCl, MgO и MgCl2 построены из ионов. Катионы чередуются с анионами. Понятие «молекула» применяется к ним условно.
Таким образом, ионная связь образуется между атомами металлов и атомами неметаллов.
Задания для закрепления
84) Самостоятельно составьте электронные схемы образования Na2O, BaBr2, CaS, KI, Li3N.
§2.2. Ковалентная химическая связь.
Разновидности связи, характеристика связи.
Валентность. Степень окисления
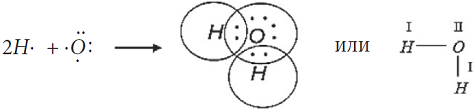
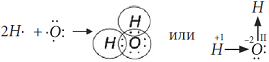
Рассмотрим, как соединяются в молекулу два атома водорода.
Электронная конфигурация атома H1s
1
или:
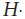
. Такое состояние атома неустойчиво. Положительное ядро атома водорода притягивает отрицательный электрон от другого атома водорода, два атома сближаются. При этом на определенном расстоянии друг от друга
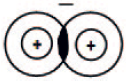
начинает действовать сила взаимного отталкивания ядер, которая возрастает при дальнейшем сближении атомов. Наконец, силы отталкивания и притяжения сравняются. При этом электронные облака двух атомов перекрываются:
Область перекрывания облаков лежит точно посередине между ядрами и удерживает их друг около друга, так как эта область повышенного отрицательного заряда.
Образовалась химическая связь. Механизм образования связи – обменный (один электрон – от одного атома, второй электрон – от другого). Область повышенной электронной плотности (область перекрывания облаков) означает, что оба электрона принадлежат двум атомам и чаще всего их можно обнаружить именно в этом пространстве между ядрами. Каждый атом приобрел устойчивую внешнюю электронную оболочку благородного газа гелия He.
Электронная схема образования молекулы H2:
Заменив общую электронную пару черточкой, получим структурную формулу молекулы
H2:
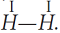
Одна общая электронная пара равносильна одной химической связи. Так как каждый атом H образовал одну химическую связь, то он одновалентен. Валентность пишется римской цифрой над атомом.
Валентность – это число химических связей, образованных атомом.
Химическая связь, образованная за счет общей электронной пары, называется ковалентной.
По способу перекрывания электронных облаков ковалентные связи подразделяются на σ- (сигма) и 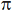 (пи)-связи. В молекуле H2 реализуется σ-связь.
(пи)-связи. В молекуле H2 реализуется σ-связь. Химическая связь, при которой область перекрывания электронных облаков лежит на линии, соединяющей два ядра, называется
сигма (σ)-связью. В данном случае перекрываются два s-облака, поэтому связь σ s-s.
В образовании химической связи в молекуле Cl2 принимает участие неспаренный p-электрон каждого атома.
Электронная конфигурация валентных электронов атома хлора:
Атом хлора имеет три пары спаренных электронов и один неспаренный, укажем их точками:
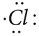
Неспаренные p-электроны двух атомов спариваются и становятся общими для двух атомов. При этом каждый атом приобретает устойчивую внешнюю восьмиэлектронную структуру инертного газа аргона Ar (3s23p6).
Электронная схема образования молекулы Cl2:
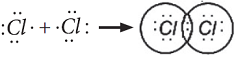 - электронная формула молекулы Cl2
- электронная формула молекулы Cl2Одна общая электронная пара, следовательно, одна химическая связь. Структурная формула молекулы
Cl2:
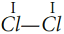
.
Каждый атом образует одну химическую связь, поэтому он одновалентен. Одна химическая связь может быть только сигма связью. Общие электроны связи в одинаковой мере принадлежат обоим атомам, находятся точно посредине между двух ядер, так как атомы одинаковые и с одинаковой силой тянут на себя электроны.Такая связь называется ковалентной неполярной.
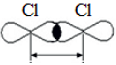
В молекуле
Cl2 происходит перекрывание
p-облаков и образуется сигма (σ)-связь
p-p:
При образовании молекулы O2 два неспаренных валентных p-элек-трона каждого атома O образуют две пары общих электронов, т.е. две химические связи.
Электронная конфигурация атома О:
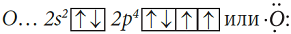
Электронная схема образования молекулы O2:
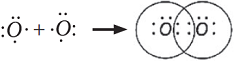 - электронная формула молекулы О2
- электронная формула молекулы О2Две пары общих электронов равносильны двум химическим связям.
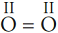
- структурная формула молекулы
О2 Так как атом кислорода образует две химические связи, он двухвалентен.
Связь двойная
ковалентная неполярная, так как образована одинаковыми атомами. 
Электронные облака двух неспаренных электронов атома кислорода взаимно перпендикулярны друг другу. Одно из них образует
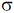
-связь p-p:
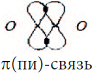
Другое
p-облако образует с таким же облаком второго атома кислорода
(пи)-связь, в плоскости, перпендикулярной первой:
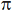 (пи)- связь отличается от
(пи)- связь отличается от  -связи тем, что область перекрывания электронных облаков лежит выше и ниже линии, соединяющей два ядра.
-связи тем, что область перекрывания электронных облаков лежит выше и ниже линии, соединяющей два ядра.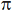 (пи)-связь менее прочная, чем
(пи)-связь менее прочная, чем 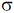 (сигма)
(сигма), так как в случае p-связи между положительно заряженными ядрами нет отрицательного заря-да, поэтому они отталкиваются друг от друга и ослабляют её, тогда как в σ-связи на пути между положительными ядрами расположена отри-цательная область перекрывания облаков, которая стягивает два ядра. Если между двумя атомами образуются две связи, то одна из них σ, а другая –
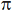
-связь.
В общем случае, если между двумя атомами три химические связи, то одна из них всегда
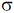
, а две другие –
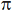
-связи
Электронная схема образования HCl:
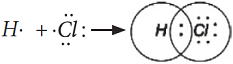
- электронная формула молекулы
H - Cl – структурная формула молекулы
Перекрывание электронных облаков:
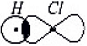
Общая электронная пара в молекуле HCl одна, то есть образуется одна химическая связь по обменному механизму, следовательно, атом H и атом Cl одновалентны:
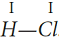
Общая электронная пара не находится посредине между ядрами двух атомов, а смещена к более электроотрицательному атому хлора
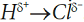
.
Отчего на атоме хлора образуется частичный отрицательный заряд, а на атоме водорода – частичный положительный, то есть образуются полюса – положительный и отрицательный, такая связь называется ковалентной полярной.
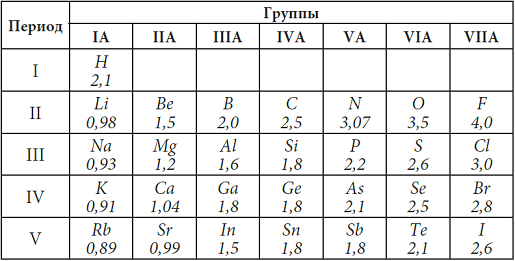
Электроотрицательность – свойство атома притягивать общую электронную пару. Наибольшей электроотрицательностью обладает элемент с наименьшим радиусом атома – F. Его относительная электроотрицательность принята равной 4.0, а наименьшей электроотрицательностью обладает атом с наибольшим радиусом – франций Fr. Так как относительная электроотрицательность связана с радиусом атома, который изменяется периодически в зависимости от заряда ядра атома, то относительная электроотрицательность (э.о.) также изменяется периодически.
Таблица 6. Относительная электроотрицательность атомов (э.о.)
В таблице 6 даны относительные электроотрицательности атомов. В периоде слева направо э.о. возрастает, а в подгруппе А сверху вниз э.о. уменьшается. Свойство притягивать электроны – свойство неметалла и, как видим из таблицы, в периоде слева направо усиливаются неметаллические свойства и увеличивается электроотрицательность. В главных подгруппах сверху вниз неметаллические свойства веществ, образованных данными атомами, уменьшаются, и уменьшается их электроотрицательность.
Ряд электротрицательности, который необходимо запомнить:
Рис. 17. Ряд электроотрицательности неметаллов
Вернемся к молекуле
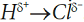
. Молекула представляет из себя диполь («ди» в переводе с греческого означает «два», два полюса – положительный и отрицательный). От атома водорода
к атому хлора сместился
один электрон и принес отрицательный заряд, поэтому степень окисления хлора равна
(-1), а
от атома водорода сместился также один электрон, степень окисления водорода
(+1):
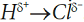
Степень окисления – это число смещенных электронов, или заряд, который получит атом, если предположить, что связь ионная. В случае молекул H2, O2, Cl2, когда атомы, образующие связь, одинаковы и нет смещения общей электронной пары от центра симметрии молекулы, степень окисления атома равна нулю:
В молекуле H2O атом кислорода образует две химические связи с двумя атомами водорода за счёт своих двух неспаренных электронов. Он двухвалентен. Атом водорода всегда одновалентен, так как имеет только один электрон. Неспаренные электроны атома кислорода находятся на взаимноперпендикулярных p-орбиталях, поэтому молекула H2O имеет угловое строение.
Электронная схема образования молекулы H2O:
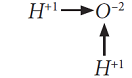
Общие электроны связей смещены к более электроотрицательному атому кислорода. Поэтому связи ковалентные полярные:
От двух атомов водорода по двум связям смещено два электрона, которые приносят отрицательный заряд, поэтому степень окисления кислорода равна (-2). От каждого атома водорода смещено по одному электрону, они уносят с собой отрицательный заряд и оставляют положительный заряд протонов, поэтому степень окисления водорода (+1).
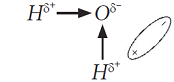
Молекула
H2O имеет угловое строение. Если сложить два вектора связей, результирующий вектор не равен нулю и будет направлен к кислороду. Поэтому молекула воды полярна, то есть представляет из себя диполь:
Задания для закрепления
85) Составьте электронные схемы образования молекул N2, HI, NH3, CH4. Покажите, что атомы приобрели устойчивую восьмиэлектронную оболочку, запишите структурные формулы молекул и определите валентность и степень окисления каждого атома.
86) Из предложенного перечня выберите три элемента-неметалла и расположите их в порядке уменьшения их электроотрицательности:
1) N 2) Be 3) O 4) Rb 5) Cl
Ответ:

Укажите номера правильных ответов (несколько цифр).
87) Из предложенного перечня выберите три элемента-неметалла и расположите их в порядке увеличения их электроотрицательности:
1) H 2) I 3) S 4) Sc 5) Ge
Ответ:

Укажите номера правильных ответов (несколько цифр).
Характеристика химической связи
Химическая связь характеризуется длиной, прочностью, кратностью, полярностью, направленностью, насыщаемостью.
Энергия связи – это энергия, которую необходимо затратить на разрыв химической связи, измеряется в кДж/моль.
При образовании любой химической связи энергия всегда выделяется. Чем в бóльшей степени перекрываются электронные облака, тем больше энергии при этом выделяется, тем прочнее химическая связь.
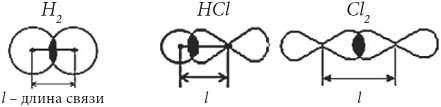
Длина связи – это расстояние между ядрами двух атомов, образовавших химическую связь.
Кратность связи определяется числом общих электронных пар между двумя атомами.Связь бывает одинарная (
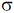
-связь), двойная (одна
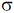
- и одна
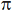
-связь), тройная (одна
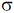
- и две
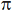
-связи).
Примеры веществ:
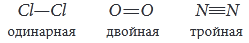
Мерой прочности связи является энергия связи. Чем больше энергия связи, тем прочнее связь.
Тройная связь прочнее двойной, а двойная – прочнее одинарной.
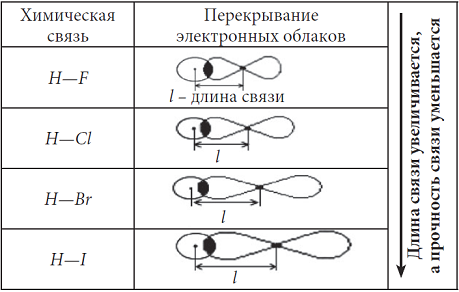
Прочность связи также связана с длиной связи. Например, в ряду однотипных молекул H—F, H—Cl, H—Br, H—I увеличивается длина связи, так как увеличивается радиус атома в ряду F, Cl, Br, I:
С увеличением длины связи уменьшается притяжение ядер атомов к области перекрывания электронных облаков, следовательно, уменьшается прочность связи.
Мерой полярности химической связи является разность электроотрицательностей атомов, образующих данную связь. Чем больше эта разность, тем больше смещена общая электронная пара к одному из атомов, тем более полярна связь.
Сравним полярность связей HF и HCl, для чего рассчитаем разность электроотрицательностей (э.о.), пользуясь таблицей электроотрицательности (см. табл. 6): э.о. (H) = 2,1; э.о. (F) = 4,0; э.о. (Cl) = 3,0.
Связь HF: э.о. (F) – э.о. (H) = 4,0 – 2,1 = 1,9.
Связь HCl: э.о. (Cl) – э.о. (H) = 3,0 – 2,1 = 0,9.
1,9 > 0,9 – полярность связи HF больше, чем HCl.
Но в данном случае в двух сравниваемых молекулах имеется атом водорода и можно обойтись без расчётов. Фтор более электроотрицателен, чем хлор, поэтому молекула HF более полярна.
Ионную химическую связь можно считать крайним случаем полярности связи. Мы знаем также, что ионная связь ненаправлена и ненасыщаема. При образовании ковалентной связи область перекрывания облаков находится в определенном направлении по отношению к взаимодействующим ядрам:
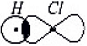
Поэтому ковалентная связь обладает направленностью.
Число ковалентных связей, которые может образовать атом по обменному механизму, ограничено максимальным числом неспаренных валентных электронов в максимально возбужденном состоянии атома (см. таблицу ниже), поэтому ковалентная связь насыщаема.
Итак, ковалентную химическую связь образуют атомы неметаллов. Разные по электроотрицательности неметаллы образуют ковалентную полярную связь, а одинаковые атомы образуют ковалентную неполярную связь. Ковалентная связь направлена и насыщаема. Атомы неметаллов с металлами образуют ионную связь, которая ненаправлена и ненасыщаема.
В образовании связей участвуют валентные электроны, происходит снижение полной энергии молекулы по сравнению с суммарной энергией взаимодействующих атомов. Лишняя энергия выделяется и называется энергией связи.
Чем больше энергии выделяется, тем прочнее связь.
Задания для закрепления
88) Составьте электронные схемы образования молекул HBr, NF3, LiF, BaO, SiCl4, H2Se, I2, CO2, K2S. Определите тип связи. В случае ковалентной химической связи определите валентность и степень окисления атомов и нарисуйте структурную формулу молекулы и перекрывание электронных облаков.
89) В каком ряду записаны формулы веществ только с ковалентной полярной связью:
1) HCl, KCl, SF6; 2) NH3, ClF, HF; 3) NO2, P4, HBr; 4) CCl4, I2, H2S.
Укажите номера правильных ответов (одна цифра).
90) Тремя общими электронными парами образована ковалентная связь в молекуле:
1) NH3; 2) N2; 3) K3N; 4) O2.
Укажите номера правильных ответов (одна цифра).
91) Ковалентная неполярная связь реализуется в соединении:
1) B2O3; 2) S8; 3) CH4; 4) HI.
Укажите номера правильных ответов (одна цифра).
92) Число σ-связей в молекуле CO2:
1) 1 2) 2 3) 3 4) 4.
Укажите номера правильных ответов (одна цифра).
93) Ионный характер связи наиболее выражен в соединении:
1) KF; 2) HF; 3) As2O5; 4) NO.
Укажите номера правильных ответов (одна цифра).
94) Атомы химических элементов III-го периода периодической системы Д.И. Менделеева образуют соединение с наиболее выраженным ионным характером связи:
1) MgF2; 2) SiO2; 3) Al2S3; 4) NaCl.
Укажите номера правильных ответов (одна цифра).
95) Длина связи увеличивается в ряду:
1) NH3, AsH3, PH3; 2) H2O, H2S, HCl; 3) H2O, H2S, H2Se; 4) HCl, HI, HBr.
Укажите номера правильных ответов (одна цифра).
96) Число связей увеличивается в ряду:
1) CO2, CCl4; 2) NO2, NH3; 3) N2, H2O; 4) PCl3, SO2.
Укажите номера правильных ответов (одна цифра).
97) Прочность связи увеличивается в ряду:
1) Cl2, O2, N2; 2) HF, HBr, HCl; 3) O2, N2, Cl2; 4) HI, HF, HCl.
Укажите номера правильных ответов (одна цифра).
98) Установите соответствие между формулой вещества и числом σ-связей в молекуле этого вещества:
| Вещество | | Число σ-связей |
| А) SO3 | | 1) 1 |
| Б) N2 | | 2) 2 |
| В) CO2 | | 3) 3 |
| | | 4) 4 |
| | | 5) 5 |
| | | 6) 6 |
Ответ:

К каждой позиции, обозначенной буквой, выберите позицию, обозначенную цифрой. Например, в ответе нужно записать 132.
99) Ионную связь образуют:
1) Rb и Br; 2) As и Cl; 3) Si и O; 4) Te и F.
Укажите номера правильных ответов (одна цифра).
100) Оцените правильность суждений о химической связи:
А) При образовании химической связи энергия всегда выделяется;
Б)
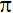
-связь прочнее σ-связи;
1) Верно только А; 2) Верно только Б; 3) Верны оба суждения; 4) Оба суждения неверны.
Укажите номера правильных ответов (одна цифра).
101) Оцените правильность суждений о химической связи:
А) При разрыве некоторых связей происходит выделение энергии;
Б) Ионная химическая связь ненаправлена и ненасыщаема;
1) Верно только А; 2) Верно только Б; 3) Верны оба суждения; 4) Оба суждения неверны.
Укажите номера правильных ответов (одна цифра).
102) Оцените правильность суждений о химической связи:
А) Двойная связь прочнее, чем одинарная;
Б) Чем больше энергии выделяется при образовании связи, тем прочнее связь;
1) Верно только А; 2) Верно только Б; 3) Верны оба суждения; 4) Оба суждения неверны.
Укажите номера правильных ответов (одна цифра).
103) Из предложенного перечня выберите два соединения с наиболее полярной связью:
1) PH3; 2) BrCl3; 3) SiO2; 4) HF; 5) P2S3.
<Ответ:

Укажите номера правильных ответов (две цифры).
104) Из предложенного перечня выберите три соединения с ковалентной полярной связью.
Расположите их в порядке увеличения длины связи:
1) SCl4; 2) P4; 3) CsCl; 4) SiCl4; 5) PCl3.
Ответ:

Укажите номера правильных ответов (три цифры).
105) Из предложенного перечня выберите три соединения с ковалентной полярной связью. Расположите их в порядке увеличения полярности связи:
1) S8; 2) KH; 3) HI; 4) PH3; 5) HBr.
Ответ:

Укажите номера правильных ответов (три цифры).
106) Из предложенного перечня выберите три вещества с ковалентной полярной связью. Расположите их в порядке увеличения прочности связи в молекуле:
1) Cl2O; 2) SCl4 3) SrCl2; 4) Cl2; 5) SeCl4.
Ответ:

Укажите номера правильных ответов (три цифры).
107) Из предложенного перечня веществ выберите три, в молекулах которых имеется
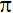
-связь. Расположите их в порядке увеличения полярности связи:
1) O
2; 2) P
4; 3) CO
2; 4) PF
5; 5) SO
3.
Ответ:

Укажите номера правильных ответов (три цифры).
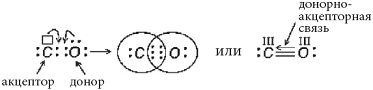
§2.3. Донорно-акцепторный механизм образования ковалентной связи
Ранее был рассмотрен обменный механизм образования ковалентной связи, когда каждый атом, образующий химическую связь, дает по
одному электрону в общее пользование, получается общая электронная пара, связывающая ядра двух атомов. Электронную пару в общее пользование может дать один атом (донор), а другой предоставит свободную орбиталь (акцептор). Образованная таким способом химическая связь является разновидностью ковалентной связи, так как образована общей
парой электронов и отличается лишь механизмом образования, который называется донорно-акцепторным механизмом.
Рассмотрим несколько случаев образования донорно-акцепторной связи:
1) В молекуле
NH3 атом азота образует три химические связи с тремя атомами водорода, у него остается одна пара валентных спаренных электронов, так как электронная конфигурация валентных электронов
атома азота следующая:
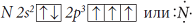
Электронная схема образования
NH3:
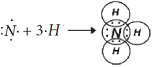
Cвободная валентная пара электронов атома азота может участвовать в образовании ковалентной связи по донорно-акцепторному механизму, а именно атом азота в молекуле :NH3 может быть донором электронов. Акцептором электронов может быть катион водорода (протон), у которого не осталось электронов, но имеется свободная валентная орбиталь.
Электронная схема образования
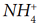
:
Заменив общие пары электронов черточками, получим структурную формулу иона аммония:
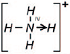
Ион водорода принес с собой положительный заряд. В образованном ионе аммония азот четырехвалентен, так как имеет четыре химические связи. Четвёртая связь, образованная по донорно-акцепторному механизму, в итоге ничем не отличается от трех других. Чтобы показать донорно-акцепторную связь, отмечаем ее стрелкой, направленной от донора к акцептору.
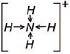
На рисунке справа показано смещение электронных пар. Четыре связи ковалентные полярные, общие пары электронов смещены в сторону более электроотрицательного атома азота.
В четвертой химической связи атом водорода не дал ни одного электрона (изначально был ион водорода H+, не имеющий электронов), поэтому к атому азота от атомов водорода смещены только три электрона, значит, степень окисления азота равна (-3):
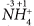
2) По донорно-акцепторному механизму образуется и ион H3O+ (ион гидроксония) из молекулы H2O и протона H+.
Конфигурация валентных электронов атома кислорода
то есть атом кислорода имеет два неспаренных электрона и две пары спаренных электронов:
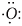
В молекуле H2O у атома кислорода остались незадействованными две пары валентных электронов, поэтому он может быть донором электронов при образовании иона H3O+.
Электронная схема образования иона гидроксония:
В ионе H3O+ атом кислорода образовал три химические связи, поэтому он трехвалентен. Все три связи ковалентные полярные, общие электроны связей смещены к более электроотрицательному атому кислорода. Два атома водорода дали в общее пользование каждый по одному электрону, третий атом H не имел электронов, был ионом H+, оба электрона связи были от атома кислорода, поэтому степень окисления атома кислорода
(-2) – по числу смещенных электронов, степень окисления атома H – (+1).
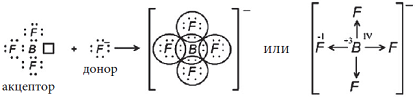
3) Ион [BF4]–
Электронная конфигурация валентных электронов атома бора в основном состоянии:
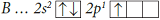
. В возбужденном состоянии:
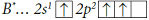
.
Атом бора в возбужденном состоянии имеет три неспаренных электрона и одну свободную валентную орбиталь
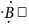
Электронная конфигурация валентных электронов атома фтора:
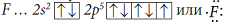
Электронная схема образования молекулы BF3:
Атом бора в молекуле BF
3 не приобрел устойчивую внешнюю восьмиэлектронную оболочку благородного газа, а имеет только шесть электронов на внешнем энергетическом уровне, но у него осталась свободная валентная орбиталь и он может выступить в качестве акцептора при образовании химической связи с донором электронов ионом
F–.
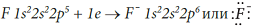
Электронная схема образования иона BF4–:
Ион F- принес c собой отрицательный заряд. В ионе BF4– атом бора приобрел устойчивую восьмиэлектронную внешнюю оболочку, образовал четыре химические связи, поэтому он четырехвалентен. Все четыре общие электронные пары смещены в сторону более электроотрицательного атома фтора, его степень окисления (-1), столько электронов смещено в сторону одного атома фтора. Степень окисления атома бора равна (+3), так как от атома бора смещено по трем связям три электрона, а четвертая связь образовалась по донорно-акцепторному механизму и бор был акцептором электронов.
4) Молекула CO. Электронная конфигурация валентных электронов:
Два неспаренных электрона атомов C и O образуют две химические связи:
Атом углерода не приобрел устойчивую восьмиэлектронную внешнюю оболочку, на внешнем энергетическом уровне у него только шесть электронов, но он может образовать еще одну химическую связь по донорно-акцепторному механизму (обозначена стрелкой), так как имеет свободную валентную орбиталь и может быть акцептором электронов, а атом кислорода имеет свободную валентную электронную пару и может быть донором электронов:
Атом углерода приобрел устойчивую восьмиэлектронную внешнюю оболочку. В молекуле CO три химические связи, поэтому атомы углерода и кислорода имеют валентность III. От атома углерода к более электроотрицательному атому кислорода по двум химическим связям смещено два электрона, а по третьей связи ни одного, так как в этой связи углерод являлся акцептором. По количеству смещенных электронов углерод имеет степень окисления (+2), а кислород – (-2):
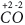
То, что в молекуле CO три химические связи, как и в молекуле N2, подтверждают близкие значения их энергий связи.
Eсв. (CO) = 1076 кДж./моль; Eсв. (N2) = 945 кДж./моль.
Для сравнения: Eсв. (O2) = 498 кДж./моль O = O
Eсв. (Cl2) = 243 кДж./моль Cl – Cl
Самое низкое значение Eсв. (Cl2), где одинарная химическая связь, выше – значение Eсв. (O2), где двойная химическая связь, и ещё выше Eсв. (N2) ≈ Eсв. (CO), где тройная химическая связь.
5) O3
Электронная конфигурация валентных электронов атома
O:
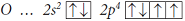
или
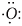
– в основном состоянии. Возбужденное состояние атома возможно не только при распаривании электронных пар, но и при спаривании неспаренных электронов:
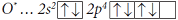
или
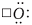
. Два неспаренных электрона двух атомов кислорода в основном состоянии образуют две химические связи:
Затем молекула O2 образует донорно-акцепторную связь с возбужденным атомом кислорода:
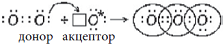 – электронная формула молекулы O3
– электронная формула молекулы O3Заменим общие электронные пары черточками, получим структурную формулу молекулы. Донорно-акцепторную связь покажем стрелкой:
Все атомы кислорода имеют разную валентность, а степень окисления у всех равна нулю, так как связи ковалентные неполярные, смещения электронов нет.
6) Образование молекулы NO (одна из гипотез).
Электронная схема образования молекулы NO:
Получается химическая связь – не двойная, не тройная, а промежуточная между ними (порядок связи 2,5). Такая гипотеза подтверждается энергией связи Eсв.(NO) = 678 кДж./моль. Это значение является промежуточным между энергией тройной связи Eсв.(N2) = 945 кДж./моль и двойной связи Eсв.(O2) = 498 кДж./моль. Молекула NO, имеющая неспаренный электрон, называется радикалом, и обладает магнитными свойствами, втягивается в магнитное поле.
7) NO2 является, как и NO, радикалом, и также обладает магнитными свойствами. Одна из гипотез образования NO2:
Энергии двух связей NO одинаковы и указывают на наличие не одинарной и не двойной, а полуторных связей.
8) HNO3. Структурная формула молекулы изображается так:
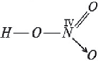
Атом азота четырехвалентен. Одна из четырех связей его с кислородом – донорно-акцепторная. Донором является атом азота, так как имеет электронную пару, а акцептором – атом кислорода в возбужденном состоянии:
Степень окисления атома азота в этом соединении равна (+5), так как все пять его электронов смещены к более электроотрицательным атомам кислорода. Причем по одинарной донорно-акцепторной связи от азота к кислороду смещено 2e. По всем остальным связям от азота к кислороду по каждой связи смещено по 1e, так как эти связи образованы по обменному механизму:
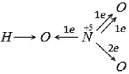
Задания для закрепления
108) Самостоятельно составьте электронные схемы образования молекул и ионов, фигурирующих в тексте, и определите валентность и степень окисления элементов.
109) Из предложенного перечня выберите два, в которых имеется донорно-акцепторная связь.
1) B2O3;
2) NH3;
3) O3;
4) (NH4)2S;
5) (NH2)2CO
Ответ:

Укажите номера правильных ответов (несколько цифр).
110) Из предложенного перечня выберите три соединения с ковалентной полярной связью. Расположите их в порядке увеличения прочности связи в молекуле.
1) S8;
2) CO;
3) CS2;
4) CO2;
5) Li2S
Ответ:

Укажите номера правильных ответов.
111) Из предложенного перечня выберите три соединения с наибольшим числом связей в молекуле.
1) HNO3;
2) NCl3;
3) SO3;
4) PCl5;
5) CS2.
Ответ:

Укажите номера правильных ответов. Расположите их в порядке увеличения числа
-связей в молекуле.
112) Выберите две частицы, в которых валентность элемента численно не совпадает со степенью окисления этого же элемента:
1) NH3;
2) H3O+;
3) SO3;
4) Cl2O;
5) N2O5.
Ответ:

Укажите номера правильных ответов(две цифры).
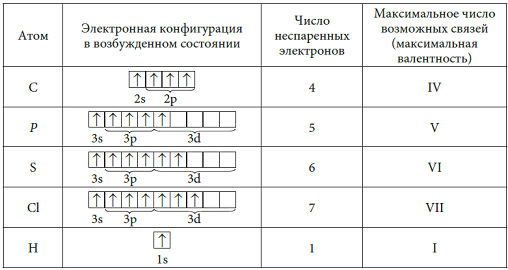
§2.4. Валентные возможности атомов
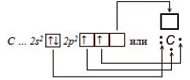
В §2.2. мы рассмотрели образование ковалентной связи по обменному механизму. Число химических связей, образуемых атомом, зависит в этом случае от числа неспаренных электронов. Если углерод имеет в возбужденном состоянии 4 неспаренных электрона, то может образовать четыре химические связи по обменному механизму и проявляет валентность IV.
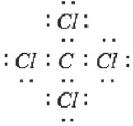
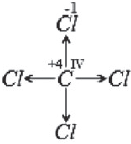
Валентность IV, равная номеру группы – это максимальная валентность атома углерода.
У атома водорода всего 1e, поэтому он всегда одновалентен. Для водорода и других атомов-неметаллов, кроме элементов II-го периода, инертных газов He, Ne, Ar, максимальная валентность равна номеру группы:
Для элементов II-го периода B, N, O и F максимальная валентность не совпадает с номером группы. Для бора и азота их высшая валентность определяется числом валентных орбиталей и равна IV, так как бор, имея свободную валентную орбиталь, может образовать дополнительно одну ковалентную связь по донорно-акцепторному механизму, являясь акцептором электронов, а атом азота может быть донором электронов за счет неподеленной валентной пары электронов и также образовать дополнительно одну ковалентную связь по донорно-акцепторному механизму (см. §2.3.)
Таким образом, азот – элемент V-ой группы – не может быть пятивалентным, а бор – элемент III-ей – группы может проявлять и валентность IV. Кислород – элемент VI-ой группы – также не может быть
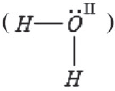
шестивалентным, так как не имеет d-подуровня для распаривания электронных пар. Максимальная его валентность равна III. Одна из трех химических связей образуется по донорно-акцепторному механизму (см. §2.3.)
Чаще всего кислород двухвалентен:
F – элемент VII-ой группы – также не может быть семивалентным:
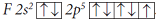
Так как у него только один неспаренный электрон, он всегда одновалентен.
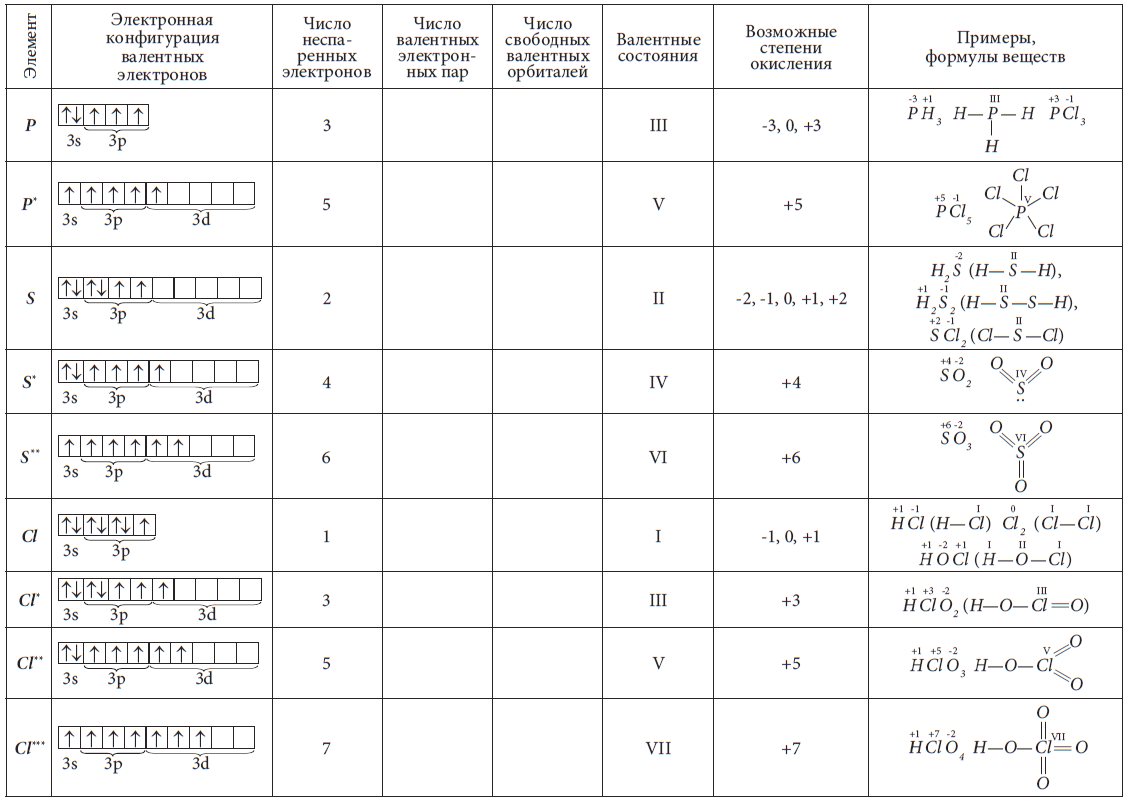
В таблице 7 показаны электронные конфигурации валентных орбиталей некоторых атомов в основном и возбужденном состояниях и их валентные состояния, а также возможные степени окисления и формулы
веществ, в которых проявляюся эти валентности и степени окисления.
Инертные газы He, Ne и Ar не образуют соединений. Максимальная валентность благородных газов Xe, Rn равна VIII и проявляется в немногочисленных соединениях со фтором и кислородом: XeF8, XeO4.
Атомы неметаллов могут проявлять как положительные, так и отрицательные степени окисления. Их максимальная положительная степень окисления равна числу валентных электронов и, значит, равна номеру группы (кроме атомов кислорода и фтора). Рассмотрим на примере атома серы. Сера находится в 6-ой группе периодической системы, максимальная степень окисления равна (+6), например, в соединении
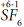
Атом S, находясь в маскимально возбужденном состоянии, образует 6 ковалентных связей, то есть является шестивалентным. Общие электронные пары связей смещены в сторону более электроотрицательных атомов фтора, по шести связям от атома серы смещено 6е, поэтому степень окисления серы (+6). Таким образом, валентность и степень окисления серы в молекуле SF6 совпадают.
Низшая степень окисления элемента-неметалла определяется числом электронов, которое может принять атом от менее электроотрицательного элемента до устойчивого восьмиэлектронного состояния и вычисляется по формуле: – (8 – № группы). Для серы: – (8 – 6) = –2. Так, в молекуле
H2S, к атому серы по двум химическим связям смещено 2
е. В этом соединении валентность и степень окисления также численно совпадают:
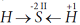
У атома серы может быть ещё одно возбужденное состояние, где 4 неспаренных электрона. В этом состоянии она проявляет валентность IV, а степень окисления +4.
Так как фтор – самый электроотрицательный элемент, то он не может иметь положительную степень окисления, а поскольку он всегда одновалентен, то его степень окисления всегда равна (-1) и только в простом веществе F2 степень окисления равна 0.
Таблица 7. Возможные валентные состояния и степени окисления некоторых элементов
Окончание табл. 7
Атомы любых металлов могут иметь только положительные степени окисления, так как не могут принимать электроны, и их низшая степень окисления равна 0. Металлы s-элементы имеют постоянную положительную степень окисления, равную номеру группы.
d-элементы, как правило, имеют непостоянные степени окисления, их максимальная степень окисления не всегда совпадает с номером группы. Так, элемент I-ой группы Cu устойчив в степени окисления (+2).
В таблице 8 даны возможные степени окисления некоторых d-элементов.
Таблица 8. Возможные степени окисления некоторых d-элементов и электронные конфигурации валентных электронов в основном состоянии
Хорошо объяснимо, что цинк может иметь только одну степень окисления (+2). Электронная конфигурация Zn … 3s23p63d104s2. Третий энергетический уровень завершен, на нем 18 электронов, и отрыв хотя бы одного из этих электронов нарушает завершенность 3d-подуровня и 3-го уровня, нарушает устойчивость атома, следовательно, энергетически невыгоден. Валентными фактически являются 4s2-электроны, хотя Zn – d-элемент, а у d-элементов валентные электроны – это электроны последнего энергетического уровня и предпоследнего d-подуровня. Отдавая 4s2-электроны, Zn проявляет степень окисления (+2).
Задания для закрепления
113) Исходя из основного и возбужденного состояний атомов Si, As, Se, Br определите их возможные валентные состояния и степени окисления.
114) Из указанных в ряду химических элементов выберите два элемента, которые в соединениях могут проявлять степень окисления +4:
1) N;
2) O;
3) Cr;
4) S;
5) P.
Ответ:

Укажите номера правильных ответов.
115) Из указанных в ряду элементов выберите два элемента, которые в соединениях могут проявлять степень окисления +6:
1) O;
2) Fe;
3) Se;
4) Sn;
5) Sr.
Ответ:

Укажите номера правильных ответов.
116) Из указанных в ряду элементов выберите два элемента, которые в соединениях могут проявлять отрицательные степени окисления:
1) O;
2) Fe;
3) Se;
4) Sn;
5) Sr.
Ответ:

Укажите номера правильных ответов.
117) Из указанных в ряду элементов выберите два элемента, которые в соединениях проявляют постоянную степень окисления:
1) O;
2) Cr;
3) Zn;
4) Sn;
5) Sr.
Ответ:

Укажите номера правильных ответов.
118) Из указанных в ряду элементов выберите два элемента, высшая степень окисления которых не совпадает с номером группы:
1) Se;
2) Cu;
3) N;
4) Mn;
5) O.
Ответ:

Укажите номера правильных ответов (две цифры).
119) Из указанных в ряду элементов выберите два элемента, высшая степень окисления которых не совпадает с номером группы:
1) F;
2) Fe;
3) B;
4) Br;
5) Ba.
Ответ:

Укажите номера правильных ответов (две цифры).
120) Из числа указанных в ряду химических соединений выберите два, в которых степень окисления азота и его валентность численно не совпадают:
1) NH3;
2) N2;
3) NF3;
4) HNO3;
5) NOF.
Ответ:

Укажите номера правильных ответов (две цифры).
121) Из числа указанных в ряду химических соединений выберите два, в которых степень окисления кислорода и его валентность численно не совпадают.
1) O2;
2) H2O;
3) OF2;
4) CO2;
5) H2O2.
Ответ:

Укажите номера правильных ответов (две цифры).
§2.5. Металлическая связь
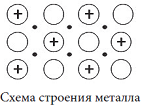
Атомы металлов, вследствие их больших радиусов, легко теряют валентные электроны. В простых веществах-металлах, а также в сплавах, часть атомов находится в виде катионов. Освободившиеся электроны легко передвигаются между атомами и ионами (они обобществлены), и как цемент связывают кирпичики-катионы между собой.
Связь между ионами металлов, осуществляемая свободнодвижущимися электронами, называется металлической.
При наложении на металл разности потенциалов относительно свободные электроны начинают двигаться от отрицательного полюса к положительному. Так объясняется электропроводность металлов. Наличием свободных электронов объясняется и теплопроводность металлов и сплавов.
Большинство металлов имеют мало валентных электронов на внешнем энергетическом уровне и много свободных валентных орбиталей. В простом веществе металле атомы и ионы настолько близко подходят
друг к другу, что происходит перекрывание их валентных орбиталей, а валентные электроны могут свободно передвигаться по всем валентным орбиталям. При деформации металла (ковка, прокатка) слои атомов и ионов могут передвигаться относительно друг друга без ущерба для металлической связи. Например, из алюминия можно получить фольгу толщиной 0,01 мм, а из золота путем ковки или прокатки – фольгу толщиной 0,0001 мм.
Таким образом, физические свойства металлов – электро- и теплопроводность, ковкость, пластичность объясняются особым их строением, металлической связью между атомами и ионами.
§2.6. Межмолекулярные силы
Вещества могут находиться в трех агрегатных состояниях: твердом, жидком и газообразном. В газах расстояние между молекулами гораздо больше размеров самих молекул. В жидкостях и твердых веществах расстояние между молекулами соизмеримо с размерами самих молекул. В жидкостях молекулы могут перемещаться относительно друг друга (текучесть), в твердых веществах движение отсутствует, имеются лишь легкие колебания относительно определенного положения.
Наличие трех агрегатных состояний веществ говорит о том, что между молекулами существуют силы взаимного притяжения. В твердых веществах они самые сильные, в жидкостях – слабее, в газах – самые слабые.
Все эти силы электрического происхождения.
Если в веществе реализуется ионная связь (например, NaCl), то оно построено не из молекул, а из ионов, которые электростатически притягиваются друг к другу и сила их притяжения (по закону Кулона) пропорциональна произведению их зарядов и обратно пропорциональна квадрату расстояния между их центрами.
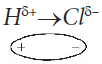
Если вещество построено из полярных молекул, которые представляют из себя диполи, например, HCl:
то между такими молекулами-диполями действуют постоянные межмолекулярные силы притяжения, называемые
ориентационными, так как один диполь ориентирует соседний диполь определенным образом, отрицательным концом к своему положительному концу. Ясно, что ориентационные силы слабее сил электростатического притяжения полноценных ионов, так как в диполях заряд только частичный, меньше одинарного.
Если вещество построено из неполярных молекул (H2, Cl2), где нет ионов и диполей, между их молекулами также существуют силы притяжения. А иначе – как объяснить, что инертные газы, состоящие из неполярных одноатомных молекул, при достаточном понижении температуры переходят в жидкое или твердое состояние?
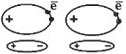
Вследствие непрерывного вращения отрицательных электронов и колебательного движения положительных ядер, в каждом из атомов всегда возможно временное смещение электронных орбит относительно ядра и обусловленное этим временное возникновение наведенных диполей:
Хотя возникающие диполи могут существовать ничтожно малое время, их возникновение повторяется практически непрерывно. Такого рода межмолекулярные силы называются дисперсионными и являются самыми слабыми. В веществах с полярными молекулами действуют и дисперсионные силы. Все виды дисперсионных сил называются «силами Ван-дер-Ваальса».
Межмолекулярные силы влияют на расстояние между частицами вещества, а, следовательно, по тому, из каких частиц построено вещество (из ионов, полярных молекул или неполярных молекул), можно предположить, каково его агрегатное состояние при комнатной температуре.
Так как в ионных соединениях существуют сильные связи между частицами вещества, то все вещества ионного строения твердые при обычной температуре. Самые слабые силы действуют между неполярными молекулами, и при комнатной температуре большинство таких веществ являются газами, где между молекулами большие расстояния: инертные газы, H2, N2, O2, F2.
Чем выше межмолекулярные силы, тем больше усилий необходимо приложить для их разрыва и перевода вещества из твердого состояния в жидкое и из жидкого в газообразное (переход этот происходит при температурах плавления (t°пл.) и кипения (t°кип.) соответственно), тем выше t°пл. и t°кип. вещества. При нагревании вещества его частицы (ионы, молекулы, атомы) получают тепловую энергию. Чем сильнее связаны между собой частицы вещества, тем больше энергии им требуется, чтобы разорвались связи между ними, следовательно, тем выше t°пл. и t°кип. этого вещества. У веществ ионного строения высокие t°пл. и t°кип., у веществ молекулярного строения они ниже.
Рассмотрим простые вещества F2, Cl2, Br2, I2. Их молекулы однотипны, неполярны, с одинарной ковалентной связью: F–F, Cl–Cl, Br–Br, I–I. В этом ряду радиусы атомов возрастают. Чем больше радиус атома (а значит, и его масса), тем слабее связаны с ядром валентные электроны, тем легче образуется из такого атома кратковременный диполь (атом поляризуется, становится полярным), тем сильнее межмолекулярные силы (дисперсионные), тем выше t°пл. и t°кип. вещества.
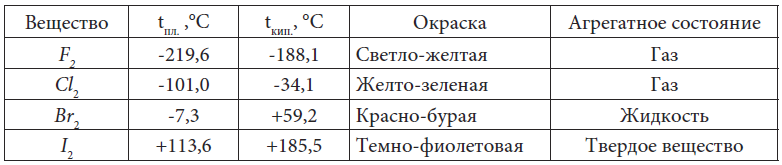
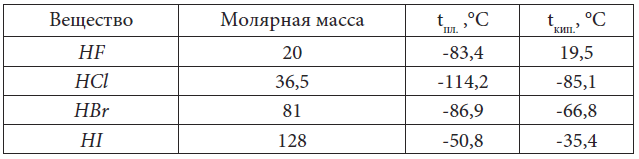
В таблице 9 даны температуры плавления и кипения галогенов и их агрегатные состояния при комнатной температуре.
Таблица 9. Физические свойства галогенов
§2.7. Водородная связь
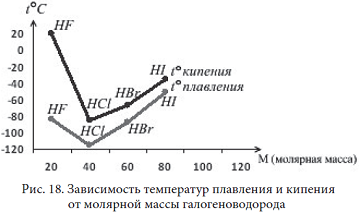
Как видим из таблицы 9, с увеличением молекулярной массы вещества в ряду F2, Cl2, Br2, I2 увеличивается и интенсивность окраски вещества от светло-желтого до темно-филетового, так как уменьшается расстояние между молекулами вследствие увеличения сил межмолекулярного притяжения. Расстояние между молекулами брома (жидкость) меньше, чем между молекулами газов F2 и Cl2, а между молекулами I2 (твердое вещество) меньше, чем в жидкости.
Среди однотипных полярных молекул HCl, HBr, HI, где имеют место и ориентационные силы, и дисперсионные, с увеличением массы вещества, так же, как и в предыдущем случае с галогенами – F2, Cl2, Br2, I2, увеличиваются дисперсионные силы.
В HCl на долю дисперсионных сил приходится 81% всего межмолекулярного взаимодействия, в HBr – 95%, а в HI – 99,5%. В связи с этим в ряду HCl, HBr, HI наблюдается закономерное увеличение t°пл. и t°кип., что видно из таблицы 10:
Таблица 10. Температуры плавления и кипения галогеноводородов
Из этого ряда выпадает HF. У него самая низкая молекулярная масса. Ожидаемо, что самые низкие должны быть t°пл. и t°кип.
HF, H2O и NH3 плавятся и кипят при аномально высоких температурах. Это объясняется образованием дополнительной межмолекулярной связи, называемой водородной, которая гораздо сильнее Ван-дер-Ваальсовой.
Водородная связь образуется между атомом водорода одной молекулы, соединенным с сильно электроотрицательным атомом F, O или N,
и сильно электроотрицательным атомом (F, O или N) другой молекулы.
Образование достаточно прочной водородной связи объясняется тем, что связь H–F (H–O, H–N) является сильно полярной вследствие высокой электроотрицательности элементов F, O, N, и общая пара электронов сильно смещена в сторону F, O и N, повышая частичный заряд на атомах и оголяя положительное ядро атома водорода, ведь у него всего один электрон.
Благодаря водородной связи образуются димеры (удвоенные молекулы), тримеры и т.д. Объединение молекул затрудняет отрыв их друг от друга и является причиной высоких t°пл. и t°кип.
Как же можно объяснить, что H2O с молекулярной массой 18 имеет t°кип. = 100 °C, а HF с большей молекулярной массой (Mr(HF) = 20) имеет t°кип. = 19,5 °C – гораздо ниже, ведь водородные связи имеются и в том, и в другом веществе, в HF даже более сильные водородные связи, так как связь H – F более полярная?
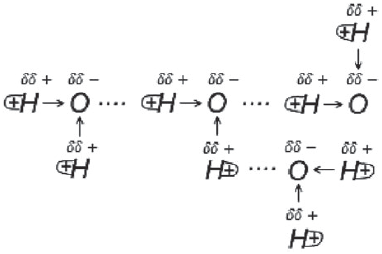
В молекуле H2O – два атома водорода, связанных с кислородом, а в HF – только один атом водорода связан с электроотрицательным атомом – в результате этого каждая молекула H2O может образовать три водородные связи с соседними молекулами, а одна молекула HF – только две водородные связи:
Все рассмотренные виды химических связей можно расположить в ряд по мере возрастания их энергии связи: Межмолекулярная

Водородная

Металлическая

Ионная и Ковалентная.
Самые прочные связи – ионные и ковалентные.
Задания для закрепления
122) Водородная связь реализуется:
1) В молекуле H2;
2) В молекуле H2O;
3) Между молекулами H2;
4) Между молекулами H2O.
Укажите номер правильного ответа.
123) Прочность водородной связи зависит от:
1) От электроотрицательности атома элемента, связанного с водородом;
2) От величины частичного положительного заряда на атоме водорода;
3) От полярности связи водород-элемент;
4) Все перечисленные выше ответы верны.
Укажите номер правильного ответа.
124) Наиболее прочные водородные связи образуются между атомом водорода и атомом:
1) Хлора;
2) Кислорода;
3) Серы;
4) Азота.
Укажите номер правильного ответа.
125) В ряду HF – HCl происходит увеличение:
1) Длины связи;
2) Полярности связи;
3) Степени окисления галогена;
4) Температуры кипения.
Укажите номер правильного ответа.
126) Образование водородной связи между молекулами веществ не оказывает влияние на
физическое свойство:
1) Температуру кипения;
2) Температуру плавления;
3) Плотность;
4) Пластичность.
Укажите номер правильного ответа.
127) Водородная связь образуется между молекулами:
1) CH4;
2) CH3OH;
3) H2S;
4) H2.
Укажите номер правильного ответа.
128) Между атомами элементов с порядковыми номерами 12 и 9 возникает связь:
1) Металлическая;
2) Ионная;
3) Ковалентная;
4) Донорно-акцепторная.
Укажите номер правильного ответа.
129) Степень окисления азота в ионе NH4+:
1) +4;
2) -4;
3) +3;
4) -3.
Укажите номер правильного ответа.
130) Установите соответствие между веществом и видом связи в этом веществе:
| Формула | | Класс вещества |
| 1) Zn | | А) Ионная |
| 2) NH3 | | Б) Ковалентная полярная |
| 3) O2 | | В) Ковалентная неполярная |
| 4) CaBr2 | | Г) Металлическая |
К каждой позиции, обозначенной цифрой, выберите позицию, обозначенную буквой. Например, в ответе нужно записать АВГБ.
131) Установите соответствие между видом связи в веществе и формулой химического вещества:
| Вид связи | | Формула вещества |
| А) Ионная | | 1) N2 |
| Б) Ковалентная полярная | | 2) Cu |
| В) Ковалентная неполярная | | 3) MgO |
| Г) Металлическая | | 4) N2O |
К каждой позиции, обозначенной буквой, выберите позицию, обозначенную цифрой. Например, в ответе нужно записать 1243.
132) Из предложенного перечня веществ выберите два вещества, в молекулах которых имеется ковалентная неполярная связь:
1) S8;
2) K2S;
3) SO2;
4) H2S;
5) H2.
Ответ:

Укажите номера правильных ответов.
133) Из предложенного перечня веществ выберите два вещества, в молекулах которых имеется ковалентная полярная связь:
1) O3;
2) BaS;
3) SF6;
4) AsCl3;
5) CsF.
Ответ:

Укажите номера правильных ответов.
134) Из предложенного перечня веществ выберите два вещества, в которых присутствует ионная химическая связь.
1) Cl2O;
2) Rb2S;
3) CS2;
4) SiO2;
5) CrCl3.
Ответ:

Укажите номера правильных ответов.
135) Из предложенного перечня веществ выберите два вещества, в которых присутствует ионная связь.
1) B2O3;
2) BaS;
3) CS2;
4) Mn2Si;
5) SiC.
Ответ:

Укажите номера правильных ответов.
136) Из предложенного перечня выберите три вещества с наибольшей температурой кипения. Расположите их в порядке возрастания температур кипения.
1) N2;
2) H2O;
3) O2;
4) H2;
5) H2S;
Ответ:

Укажите номера правильных ответов.
137) Из предложенного перечня выберите три вещества с наименьшей температурой кипения. Расположите их в порядке уменьшения температур кипения:
1) H2O;
2) Ne;
3) K2S;
4) F2;
5) Cl2;
Ответ:

Укажите номера правильных ответов.
138) Из предложенного перечня выберите три вещества с наибольшей температурой кипения. Расположите их в порядке увеличения температур кипения:
1) HF;
2) CO;
3) NaCl;
4) H2;
5) HBr;
Ответ:

Укажите номера правильных ответов.
139) Из предложенного перечня выберите три вещества с наибольшей температурой кипения. Расположите их в порядке увеличения температур кипения:
1) NH3;
2) He;
3) H2O;
4) PH3;
5) CaO;
Ответ:

Укажите номера правильных ответов.




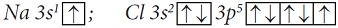

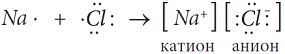

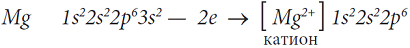
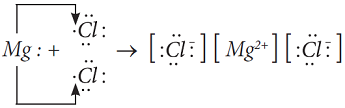
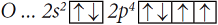
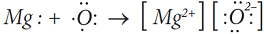
 или:
или:  . Такое состояние атома неустойчиво. Положительное ядро атома водорода притягивает отрицательный электрон от другого атома водорода, два атома сближаются. При этом на определенном расстоянии друг от друга
. Такое состояние атома неустойчиво. Положительное ядро атома водорода притягивает отрицательный электрон от другого атома водорода, два атома сближаются. При этом на определенном расстоянии друг от друга  начинает действовать сила взаимного отталкивания ядер, которая возрастает при дальнейшем сближении атомов. Наконец, силы отталкивания и притяжения сравняются. При этом электронные облака двух атомов перекрываются:
начинает действовать сила взаимного отталкивания ядер, которая возрастает при дальнейшем сближении атомов. Наконец, силы отталкивания и притяжения сравняются. При этом электронные облака двух атомов перекрываются: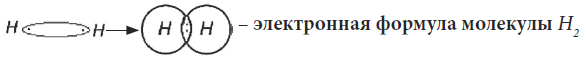
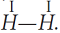
 (пи)-связи. В молекуле H2 реализуется σ-связь. Химическая связь, при которой область перекрывания электронных облаков лежит на линии, соединяющей два ядра, называется сигма (σ)-связью. В данном случае перекрываются два s-облака, поэтому связь σ s-s.
(пи)-связи. В молекуле H2 реализуется σ-связь. Химическая связь, при которой область перекрывания электронных облаков лежит на линии, соединяющей два ядра, называется сигма (σ)-связью. В данном случае перекрываются два s-облака, поэтому связь σ s-s.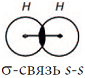
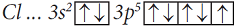
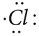
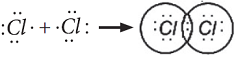 - электронная формула молекулы Cl2
- электронная формула молекулы Cl2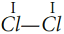 .
. В молекуле Cl2 происходит перекрывание p-облаков и образуется сигма (σ)-связь p-p:
В молекуле Cl2 происходит перекрывание p-облаков и образуется сигма (σ)-связь p-p: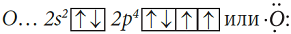
 - электронная формула молекулы О2
- электронная формула молекулы О2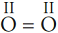 - структурная формула молекулы О2
- структурная формула молекулы О2  Электронные облака двух неспаренных электронов атома кислорода взаимно перпендикулярны друг другу. Одно из них образует
Электронные облака двух неспаренных электронов атома кислорода взаимно перпендикулярны друг другу. Одно из них образует 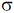 -связь p-p:
-связь p-p: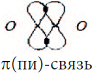 Другое p-облако образует с таким же облаком второго атома кислорода
Другое p-облако образует с таким же облаком второго атома кислорода  (пи)-связь, в плоскости, перпендикулярной первой:
(пи)-связь, в плоскости, перпендикулярной первой: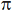 (пи)- связь отличается от
(пи)- связь отличается от 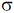 -связи тем, что область перекрывания электронных облаков лежит выше и ниже линии, соединяющей два ядра.
-связи тем, что область перекрывания электронных облаков лежит выше и ниже линии, соединяющей два ядра.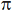 (пи)-связь менее прочная, чем
(пи)-связь менее прочная, чем 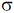 (сигма), так как в случае p-связи между положительно заряженными ядрами нет отрицательного заря-да, поэтому они отталкиваются друг от друга и ослабляют её, тогда как в σ-связи на пути между положительными ядрами расположена отри-цательная область перекрывания облаков, которая стягивает два ядра. Если между двумя атомами образуются две связи, то одна из них σ, а другая –
(сигма), так как в случае p-связи между положительно заряженными ядрами нет отрицательного заря-да, поэтому они отталкиваются друг от друга и ослабляют её, тогда как в σ-связи на пути между положительными ядрами расположена отри-цательная область перекрывания облаков, которая стягивает два ядра. Если между двумя атомами образуются две связи, то одна из них σ, а другая – 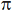 -связь.
-связь.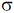 , а две другие –
, а две другие – 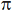 -связи
-связи - электронная формула молекулы
- электронная формула молекулы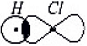
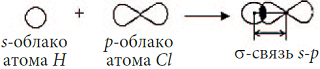
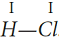
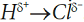 .
.
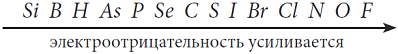
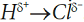 . Молекула представляет из себя диполь («ди» в переводе с греческого означает «два», два полюса – положительный и отрицательный). От атома водорода к атому хлора сместился один электрон и принес отрицательный заряд, поэтому степень окисления хлора равна (-1), а от атома водорода сместился также один электрон, степень окисления водорода (+1):
. Молекула представляет из себя диполь («ди» в переводе с греческого означает «два», два полюса – положительный и отрицательный). От атома водорода к атому хлора сместился один электрон и принес отрицательный заряд, поэтому степень окисления хлора равна (-1), а от атома водорода сместился также один электрон, степень окисления водорода (+1): 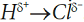
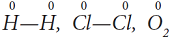
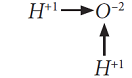 Общие электроны связей смещены к более электроотрицательному атому кислорода. Поэтому связи ковалентные полярные:
Общие электроны связей смещены к более электроотрицательному атому кислорода. Поэтому связи ковалентные полярные: Молекула H2O имеет угловое строение. Если сложить два вектора связей, результирующий вектор не равен нулю и будет направлен к кислороду. Поэтому молекула воды полярна, то есть представляет из себя диполь:
Молекула H2O имеет угловое строение. Если сложить два вектора связей, результирующий вектор не равен нулю и будет направлен к кислороду. Поэтому молекула воды полярна, то есть представляет из себя диполь:

 -связь), двойная (одна
-связь), двойная (одна 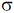 - и одна
- и одна 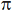 -связь), тройная (одна
-связь), тройная (одна 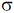 - и две
- и две 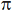 -связи).
-связи).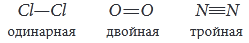
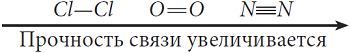
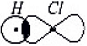

 -связь прочнее σ-связи;
-связь прочнее σ-связи;




 -связь. Расположите их в порядке увеличения полярности связи:
-связь. Расположите их в порядке увеличения полярности связи:



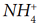 :
: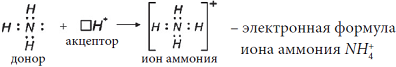

 На рисунке справа показано смещение электронных пар. Четыре связи ковалентные полярные, общие пары электронов смещены в сторону более электроотрицательного атома азота.
На рисунке справа показано смещение электронных пар. Четыре связи ковалентные полярные, общие пары электронов смещены в сторону более электроотрицательного атома азота.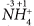
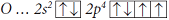
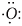
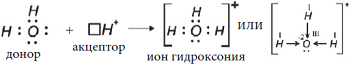
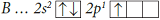 . В возбужденном состоянии:
. В возбужденном состоянии: 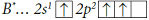 .
.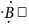
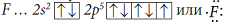
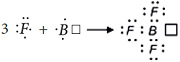
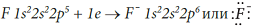
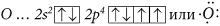
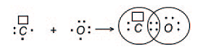
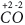
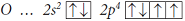 или
или 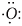 – в основном состоянии. Возбужденное состояние атома возможно не только при распаривании электронных пар, но и при спаривании неспаренных электронов:
– в основном состоянии. Возбужденное состояние атома возможно не только при распаривании электронных пар, но и при спаривании неспаренных электронов: 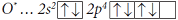 или
или  . Два неспаренных электрона двух атомов кислорода в основном состоянии образуют две химические связи:
. Два неспаренных электрона двух атомов кислорода в основном состоянии образуют две химические связи: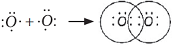
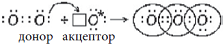 – электронная формула молекулы O3
– электронная формула молекулы O3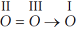
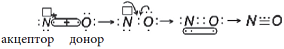
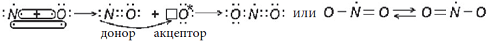
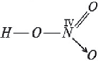
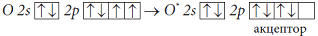
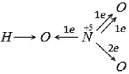



 -связей в молекуле.
-связей в молекуле.
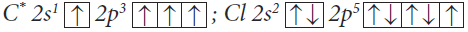

 Валентность IV, равная номеру группы – это максимальная валентность атома углерода.
Валентность IV, равная номеру группы – это максимальная валентность атома углерода.

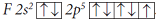
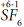
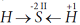









 Атомы металлов, вследствие их больших радиусов, легко теряют валентные электроны. В простых веществах-металлах, а также в сплавах, часть атомов находится в виде катионов. Освободившиеся электроны легко передвигаются между атомами и ионами (они обобществлены), и как цемент связывают кирпичики-катионы между собой.
Атомы металлов, вследствие их больших радиусов, легко теряют валентные электроны. В простых веществах-металлах, а также в сплавах, часть атомов находится в виде катионов. Освободившиеся электроны легко передвигаются между атомами и ионами (они обобществлены), и как цемент связывают кирпичики-катионы между собой.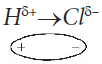 Если вещество построено из полярных молекул, которые представляют из себя диполи, например, HCl:
Если вещество построено из полярных молекул, которые представляют из себя диполи, например, HCl: Вследствие непрерывного вращения отрицательных электронов и колебательного движения положительных ядер, в каждом из атомов всегда возможно временное смещение электронных орбит относительно ядра и обусловленное этим временное возникновение наведенных диполей:
Вследствие непрерывного вращения отрицательных электронов и колебательного движения положительных ядер, в каждом из атомов всегда возможно временное смещение электронных орбит относительно ядра и обусловленное этим временное возникновение наведенных диполей: 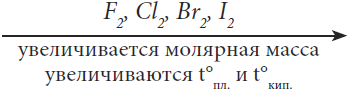
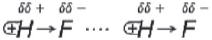
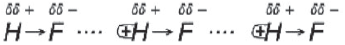
 Водородная
Водородная  Металлическая
Металлическая  Ионная и Ковалентная.
Ионная и Ковалентная.






